Rupture, reconstruction et réhabilitation : Une revue multidisciplinaire des mécanismes d'adaptation du système nerveux central après une lésion du ligament croisé antérieur.
Jun 1
/
Kinesport
1. Introduction
Depuis l'étude marquante de Kennedy et collaborateurs en 1982, identifiant des terminaisons nerveuses libres s'étendant jusqu'au ligament croisé antérieur (LCA), et celle de Schultz et collaborateurs en 1984, découvrant des mécanorécepteurs spécialisés intégrés dans son tissu, il y a eu un flux constant d'investigations suggérant que le LCA peut fournir des contributions mécaniques et sensorielles à la stabilité du genou. Au cours de la dernière décennie, un nombre croissant de preuves a suggéré que des adaptations du système nerveux central (SNC) sont à l'origine de déficits neuromusculaires persistants chez les personnes ayant subi une lésion du LCA, tels que des réductions de la capacité de contraction volontaire ou une charge articulaire aberrante. Alors que les approches thérapeutiques actuelles visent à restaurer la stabilité mécanique, les contributions au dysfonctionnement à long terme sont probablement multifactorielles et les déficiences du système sensorimoteur dans la musculature articulaire environnante, la moelle épinière et le cerveau peuvent ne pas être résolues.
Historiquement, le dysfonctionnement neuromusculaire après une lésion du LCA a été attribué à la douleur, à la distension articulaire et à la perte ou à la détérioration des mécanorécepteurs de la lésion. Cependant, les études antérieures sur le système nerveux des personnes ayant subi une reconstruction du LCA (ACLR) ont été en grande partie transversales et, par conséquent, la nature étiologique des changements neurophysiologiques n'est pas claire. Les études réalisées jusqu'à présent étaient généralement descriptives ou adaptées à des éléments spécifiques de la blessure, au lieu de prendre en compte de multiples facteurs dans le continuum des soins, tels que le bien-être psychologique, les variations chirurgicales dans la reconstruction et la réparation, l'utilisation de l'analgésie pre-opératoire et les prescriptions d'exercices pendant les soins de réadaptation.
Objectif :
Fournir une revue narrative multidisciplinaire pour :
1) Décrire l'état actuel de la littérature en faveur de la neuroplasticité chez les personnes ayant subi une blessure antérieure au LCA.
2) Souligner les mécanismes potentiels des déficits neurophysiologiques dans toutes les phases de la blessure et de la récupération (blessure, chirurgie, rééducation), qui ont fait l'objet d'un examen moins critique.
2. Examen du dysfonctionnement neurophysiologique chez les personnes ayant subi une lésion du LCA
2.1. Études utilisant les potentiels évoqués somato-sensoriels chez les personnes ayant subi une lésion du LCA
Certaines des premières études neurophysiologiques ont tenté de déterminer si les informations somato-sensorielles du LCA étaient perturbées après une lésion du LCA. Ces études ont mesuré les potentiels évoqués somato-sensoriels (SEPs) après une manipulation mécanique ou une stimulation électrique du LCA ou des nerfs voisins. On pense que les SEPs captent des signaux sensoriels spécifiques voyageant à travers la colonne dorsale de la moelle épinière jusqu'au cortex somato-sensoriel. Collectivement, ces études suggèrent que les signaux électriques provenant de la voie afférente du LCA rompu sont perdus ou réduits par rapport aux témoins sains. Des études ultérieures utilisant des techniques similaires ont également fourni des preuves que les altérations des signaux afférents peuvent avoir un impact sur l'état fonctionnel et les schémas d'activité musculaire pendant la marche.
2.2. Mesures de l'excitabilité et de la fonction intra-corticale chez les personnes ayant subi une lésion du LCA
La contraction musculaire volontaire est obtenue par le recrutement de motoneurones via des niveaux accrus d'excitabilité descendante du SNC. La production d'une force accrue au cours d'une contraction donnée nécessite une augmentation de l'activité des neurones pyramidaux dans le cortex moteur primaire et une augmentation des potentiels neuronaux dans le tractus corticospinal qui en résulte. Des amplitudes plus importantes d’impulsions descendantes augmentent le nombre d'unités motrices recrutées à partir de la moelle épinière ainsi que les taux d’activations. Cependant, plusieurs facteurs peuvent influencer la capacité à activer les pools de motoneurones pour un muscle donné, tels que les changements dans le retour sensoriel excitateur et inhibiteur, ou les changements dans la commande descendante du cortex. La faiblesse des quadriceps est une conséquence persistante des lésions du LCA, que l'on pense être secondaire à la réduction de la commande efférente de la musculature environnante du genou. De nombreux chercheurs ont utilisé la stimulation magnétique transcrânienne (TMS) à une seule impulsion pour déterminer si les mesures de l'excitabilité neuronale à travers le tractus corticospinal (excitabilité corticospinale, mesurée par l'intensité du seuil moteur et/ou les potentiels moteurs évoqués [MEP]) ou la voie réflexe Ia (excitabilité du réflexe spinal, mesurée par le rapport entre le réflexe H et l'onde-M maximale) sont mécaniquement liées aux déficiences observées dans la capacité d'activation volontaire et la fonction musculaire du quadriceps. Ces rapports suggèrent que les personnes ayant des antécédents d’ACLR présentent des niveaux différents d'excitabilité neuronale du quadriceps parmi les neurones du tractus corticospinal et de la voie afférente Ia. En outre, des études antérieures ont également montré que des seuils moteurs plus élevés (c'est-à-dire une excitabilité corticospinale réduite) sont associés à une activation volontaire réduite du quadriceps et à une force isocinétique réduite dans le membre blessé. Des études longitudinales récentes ont également suggéré que les changements dans l'excitabilité du réflexe corticospinal et spinal peuvent suivre un cours temporel à travers la blessure et la récupération. Un ensemble d’études suggèrent que les altérations de l'excitabilité des réflexes spinaux et corticospinaux peuvent être des manifestations neurophysiologiques précoces et tardives des lésions et de la récupération, respectivement. De plus, des études utilisant la TMS à paires d'impulsions, qui est un outil utile pour examiner les interactions inhibitrices et excitatrices dans le cortex moteur, ont suggéré que la fonction intracorticale peut être liée à la fonction musculaire chez les personnes souffrant d’ACLR. Par exemple, Luc-Harkey et collaborateurs ont découvert que la réduction de l'amplitude de l'inhibition corticale à intervalle court (c'est-à-dire des niveaux plus élevés d'inhibition intracorticale) est significativement liée à la réduction de l'activation volontaire du quadriceps. De même, Zarzycki et collaborateurs ont trouvé que l'inhibition intracorticale était liée à la faiblesse du quadriceps au moment où l'épanchement est résolu et où l'amplitude du mouvement est complète.
2.3. L'utilisation de techniques modernes de neuro-imagerie après une blessure et une reconstruction du LCA
Les études de neuro-imagerie utilisant les analyses spectrales de l'électroencéphalogramme (EEG) et l'imagerie par résonance magnétique fonctionnelle (IRMf) ont mis en évidence une modification de l'activité neuronale dans l'ensemble du cerveau chez les personnes ayant déjà subi une lésion ou une reconstruction du LCA. Par rapport aux participants sains, les personnes ayant subi une lésion du LCA recrutent des niveaux d'activité neuronale plus élevés dans les régions cognitives (gyrus frontal, pôle frontal) et visuospatiales (gyrus lingual), ainsi que des variations d'activité dans les zones motrices et somatosensorielles (cortex sensorimoteurs primaire et secondaire).
3. RUPTURE - Adaptations neurophysiologiques
3.1. Déafférentation
Des études histologiques ont révélé des déficits de mécanorécepteurs chez les patients après une lésion du LCA, y compris une diminution progressive des mécanorécepteurs dans le reste du LCA. Le traumatisme des mécanorécepteurs articulaires sous-jacents peut induire des effets neurophysiologiques et neurochimiques qui se superposent aux lésions des nerfs périphériques, provoquant des changements étendus et durables de l'activité neuronale au niveau de la moelle épinière, du tronc cérébral et du cortex. Ces mécanorécepteurs ont été caractérisés comme étant constitués de plusieurs types d'organes sensoriels, tels que des terminaisons nerveuses libres, des organes de Ruffini et de Pacini, et des organes tendineux de Golgi, provenant des branches postérieures du nerf tibial qui pénètrent dans la capsule articulaire. Les mécanorécepteurs articulaires ont été largement suggérés comme étant responsables de la proprioception du genou et de la détection des changements posturaux. Ces récepteurs interagissent également avec les neurones moteurs gamma des muscles fléchisseurs et extenseurs du genou et jouent un rôle dans la régulation réflexe de la stabilité articulaire et de la raideur musculaire préparatoire. On a supposé que l'atténuation des signaux afférents provenant des mécanorécepteurs articulaires à la suite d'une blessure perturbe la sensibilité normale du fuseau musculaire en raison d'une altération de la régulation de la boucle motrice gamma des fibres intrafusales, ce qui entraîne une réduction de l'activation du quadriceps et de la force produite. Il a été démontré que la désafférentation aiguë diminuait l'activation musculaire volontaire par le biais d'une défacilitation ou d'une inhibition réflexe et d'une réduction de la fréquence de décharge des axones moteurs. Ainsi, il est raisonnable de penser que la désafférentation périphérique après une blessure est un facteur contribuant à l'échec persistant de l'activation du quadriceps.
Bien qu'il ne soit pas clair quelle composante de la blessure peut prédominer dans les ruptures de la signalisation somato-sensorielle, comme mentionné ci-dessus, les auteurs pensent que les signaux SEPs proviennent de l'information sensorielle remontant les colonnes dorsales de la moelle épinière. Par conséquent, les réductions de la signalisation proviennent vraisemblablement de mécanorécepteurs articulaires endommagés. Enfin, il est également vrai que des recherches antérieures ont observé que l'absence d'afférence provoque des altérations de la fonction corticale, potentiellement en démasquant des connexions qui sont typiquement silencieuses (désinhibition).
Bien qu'il ne soit pas clair quelle composante de la blessure peut prédominer dans les ruptures de la signalisation somato-sensorielle, comme mentionné ci-dessus, les auteurs pensent que les signaux SEPs proviennent de l'information sensorielle remontant les colonnes dorsales de la moelle épinière. Par conséquent, les réductions de la signalisation proviennent vraisemblablement de mécanorécepteurs articulaires endommagés. Enfin, il est également vrai que des recherches antérieures ont observé que l'absence d'afférence provoque des altérations de la fonction corticale, potentiellement en démasquant des connexions qui sont typiquement silencieuses (désinhibition).
3.2. Inflammation et douleur
Les lésions tissulaires, l'inflammation, la douleur et d'autres caractéristiques des blessures peuvent provoquer des réponses neuroplastiques aux niveaux périphérique, spinal et cortical. Après une rupture ligamentaire partielle ou complète, un gonflement intra-articulaire rapide peut survenir à la suite d'une hémarthrose et de l'infiltration de médiateurs inflammatoires. L'aspiration du liquide articulaire du genou a révélé des niveaux accrus de cytokines pro-inflammatoires, IL-1b, IL-6, IL-8 et TNF𝛼, pendant la phase aiguë de la lésion du LCA, suivis par des niveaux accrus d'IL-10 et d'IL-4 plusieurs semaines après la lésion. Les cytokines peuvent activer les récepteurs neuronaux ou libérer des molécules neuroactives, ce qui entraîne des modifications de la transmission synaptique et de l'excitabilité neuronale. Dans le cas d'une lésion articulaire traumatique, la dérégulation des cytokines dans la capsule articulaire et les tissus environnants peut altérer la signalisation neuronale normale et la fonction synaptique. Alors que l'inflammation due à une blessure est généralement limitée à l'articulation blessée, les perturbations de la transduction du signal, de la communication synaptique et de l'excitation neuronale des nerfs périphériques environnants peuvent entraîner des modifications des seuils des récepteurs et une désafférentation supplémentaire. Des modèles d'effusion du genou ont rapporté des réductions de l'activation volontaire du quadriceps (7,6 % de réduction de l'activation centrale et 13,6 % de la force). De plus, les terminaisons nerveuses lésées (comme dans le cas d'une lésion du LCA) peuvent également déclencher une cascade d'événements systémiques, cellulaires et moléculaires tels que l'augmentation de l'expression de facteurs neurotrophiques (par ex. BDNF), de facteurs de transcription et de neuropeptides (par ex. VIP, Substance P). Par conséquent, la combinaison de l'infiltration prototypique de cytokines due au traumatisme et de la réponse inflammatoire aux lésions nerveuses peut favoriser des adaptations étendues du SNC au-delà de l'articulation. De plus, la douleur secondaire au traumatisme et/ou à l'inflammation est également susceptible de contribuer à l'inhibition musculaire et à la modification de la mécanique du mouvement. La douleur et les stimuli nocifs peuvent modifier les schémas d’activation par l'activation et la sensibilisation des fibres nerveuses Aẟ et C. Il a été démontré que la douleur aiguë au genou diminuait l'activité volontaire des quadriceps (réduction de 5,7 % de l'activation centrale et de 13,7 % de la force). Les rapports de douleur peuvent également entraîner des réductions de l'excitabilité des réflexes spinaux (réduction de 12 % du rapport H:M après une injection de solution saline hypertonique à 5 %). Ainsi, la combinaison de la sensibilisation des nerfs afférents et des réponses réflexes spinales peut être le médiateur de la relation entre la douleur et l'inhibition musculaire. Des chercheurs ont suggéré que la douleur et le gonflement dans la phase aiguë de la lésion du LCA (avant la reconstruction) sont des causes probables des réductions bilatérales de l'excitabilité des réflexes spinaux du quadriceps. Des modèles expérimentaux d'épanchement ont également suggéré que la distension articulaire peut provoquer des perturbations de la signalisation afférente, entraînant une inhibition musculaire et des réductions de l'excitabilité réflexe spinale. Alors que dans le cas d'une lésion du LCA, la douleur s'atténue à mesure que l'inflammation diminue, la reconstruction chirurgicale réinitialise les lésions tissulaires, l'inflammation et la douleur, prolongeant la stimulation des nocicepteurs qui modifie encore le traitement somato-sensoriel supra-spinal.
4. RECONSTRUCTION - Adaptations et implications neurophysiologiques
4.1. Intervention chirurgicale
Les techniques chirurgicales actuelles de reconstruction impliquent une combinaison d'incision cutanée, de dissection tissulaire, de séparation musculaire, de forage osseux et de fixation de la greffe. Par conséquent, malgré les progrès réalisés pour minimiser le caractère invasif de la chirurgie, celle-ci provoque une atteinte neurologique. Si l'on considère le contexte plus large de la chirurgie, la combinaison du traumatisme, de la stimulation afférente intra-articulaire et des réponses au stress hypothalamo-hypophysaire pendant l'opération peut imiter certains aspects de la blessure, contribuant à des réponses à la fois périphériques (par exemple, l'atrophie musculaire) et centrales (par exemple, l'inhibition neurale descendante) (Figure 1). Des études longitudinales ont révélé des déficits postopératoires de l'activation volontaire du quadriceps et des réductions bilatérales de l'excitabilité du réflexe spinal chez les personnes ayant subi une ACLR. De plus, des réductions de la connectivité des réseaux cérébraux associées à une chirurgie majeure du genou ont été rapportées, dont les régions se chevauchent avec les régions précédemment montrées comme étant altérées chez les personnes ayant des antécédents d’ACLR. Les conséquences neuromusculaires chez les personnes ayant reçu différents types de greffes ont également été étudiées, mais aucune différence n'a été observée dans l'excitabilité du réflexe spinal, l'excitabilité corticospinale ou l'activation volontaire du quadriceps en fonction du choix de la greffe (Pietrosimone & al., 2015). Par conséquent, si le type de greffe peut jouer un rôle dans d'autres aspects du traitement et de la récupération, il ne semble pas jouer un rôle significatif dans les adaptations étendues du SNC ou la capacité musculaire volontaire d'après les données disponibles. Cependant, des études de plus grande envergure sont encore nécessaires pour déterminer si le choix du greffon influence d'autres aspects de la neurophysiologie tels que la rétroaction somato-sensorielle en réponse aux changements dans la disponibilité de fuseaux neuromusculaires et d’organes tendineux de Golgi du site donneur.
4.2. Implications cliniques - Progrès dans l'approche chirurgicale
Il est important de noter que l'activation du quadriceps est plus faible dans le cas d'un LCA déficient que dans le cas d’un ACLR, ce qui indique que la reconstruction chirurgicale peut lutter contre des réductions supplémentaires de la fonction musculaire. Néanmoins, les progrès de l'approche chirurgicale qui tente de ré-innerver le ligament ou d'autres techniques peropératoires qui minimisent l’atteinte neurophysiologique, peuvent être bénéfiques pour atténuer le dysfonctionnement neuromusculaire chez les personnes nécessitant une intervention chirurgicale. Les approches actuelles qui utilisent l'autogreffe et l'allogreffe de reconstruction ne favorisent pas la ré-innervation des mécanorécepteurs. Les approches chirurgicales alternatives qui visent à préserver les mécanorécepteurs restants ou à ré-innerver les afférences articulaires, tout en permettant une stabilité mécanique suffisante, restent un défi. Les récentes avancées chirurgicales utilisant différentes techniques de réparation ligamentaire pourraient constituer une solution potentielle. La réparation du ligament croisé antérieur par pontage (BEAR), qui implique une réparation par suture du ligament déchiré combinée à un échafaudage bioactif, a récemment montré des résultats similaires aux méthodes de reconstruction standard tout en restaurant l'intégrité native du LCA. Des techniques de préservation du reliquat, qui visent à préserver le reliquat du LCA et à favoriser l'innervation et la vascularisation du greffon, ont également été proposées. Si ces techniques parviennent à conserver les mécanorécepteurs résiduels ou à favoriser la ré-innervation, elles peuvent rétablir le feedback sensoriel du genou et éviter les changements neurophysiologiques maladaptés. Une autre approche alternative est l'utilisation de polymères biodégradables comme échafaudage synthétique, permettant la régénération du LCA. Ces techniques ont permis de mettre en évidence la revascularisation du ligament de remplacement, suggérant que la ré-innervation est une possibilité. Cependant, l’ACLR reste le Gold standard et une récente revue systématique indique que l’ACLR donne des résultats supérieurs, selon les patients, et une meilleure survie du greffon que les techniques de réparation (Nwachukwu & al., 2019). Ainsi, les techniques de réparation doivent être étudiées et affinées avant d'être mises en œuvre à grande échelle.
D'autres stratégies périopératoires peuvent également servir à préserver l'intégrité neuromusculaire et à restaurer la force du quadriceps. Une étude pilote de Mendias et collaborateurs a démontré que l'administration d'hormone de croissance humaine recombinante (HGH) améliore la fonction musculaire (augmentation de 29% de la force isocinétique des quadriceps) chez les patients subissant une réparation du LCA. Les auteurs affirment que l'HGH peut agir pour prévenir l'atrophie musculaire et la douleur (par la signalisation de l'IGF-1) tout en modulant également la plasticité synaptique périphérique. Bien que l'utilisation de la HGH puisse être un complément viable à la chirurgie reconstructive, l'étendue complète des effets thérapeutiques et indésirables de la HGH dans cette population de patients reste inconnue.
4.3. Blocage nerveux périphérique - Adaptations neurophysiologiques
Pour minimiser la douleur associée à l’ACLR, les blocs nerveux périphériques peuvent être utilisés pour provoquer une déafférentation/déefférentation transitoire. Les blocs des nerfs fémoraux (BFN) offrent une analgésie postopératoire et/ou une anesthésie peropératoire du quadriceps (nerfs lombaires 2-4) pour l’ACLR et peuvent être réalisés en une seule injection, ou par une technique de cathéter continu (BFCN) utilisant une perfusion périneurale. Les BFN sont souvent réalisés en conjonction avec des blocs du nerf sciatique, ce qui permet une désafférentation/déefférentation quasi-complète du membre inférieur. Bien qu'à court terme, les BFN permettent de gérer efficacement la douleur des personnes subissant une arthroplastie du ligament croisé antérieur, des conséquences neuromusculaires prolongées ont été signalées (déficits postopératoires significatifs de la force du quadriceps, risque de rupture du greffon au cours de la première année après l'opération). Les interactions mécaniques entre le FNB et les déficits du quadriceps sont probablement multifactorielles et proviennent d'une désafférentation prolongée, d'une paralysie motrice et/ou d'une mobilisation tardive. Le FNB assure une désafférentation transitoire du membre inférieur, mais des altérations immédiates de l'entrée somatosensorielle dans le cortex ont été observées après un bloc anesthésique. De plus, des changements immédiats dans l'organisation corticale ont été rapportés après un blocage des nerfs périphériques. Par conséquent, dans ce contexte, le FNB peut imiter une amputation, en provoquant des changements étendus dans les régions corticales locales et voisines, et en exacerbant les conséquences de la désafférentation initiée par la blessure.
Bien qu'aucune étude n'ait examiné les effets centraux de la FNB chez les patients ayant subi une lésion du LCA, il a été démontré que le bloc nerveux du plexus brachial modifie la connectivité cérébrale visuelle et sensorimotrice, ce qui est similaire aux résultats observés chez les participants ayant un antécédent d’ACLR (par exemple, le gyrus lingual et le cortex pariétal). La mesure dans laquelle le FNB a un impact sur le système neuromusculaire et les résultats post ACLR reste un sujet de débat. Ainsi, certains auteurs ont conclu que le FNB n'est peut-être pas approprié chez les patients présentant déjà un risque élevé de récidive du LCA et que d'autres alternatives analgésiques devraient être envisagées.
4.4. Implications cliniques - Alternatives au bloc nerveux périphérique
Des études prospectives ont montré que les blocs du canal adducteur (ACB) peuvent préserver la force du quadriceps et fournir une analgésie postopératoire non inférieure pour les personnes subissant une ACLR. Des revues récentes d'essais contrôlés randomisés comparant l’ACB au FNB renforcent ces résultats, suggérant que le bloc du canal adducteur peut être une alternative bénéfique pour la gestion de l'analgésie des patients. Cependant, il est important de noter que les études rapportent des méthodes hétérogènes d'évaluation de la force. Par conséquent, les stratégies optimales pour la gestion périopératoire de l'analgésie peuvent encore être un sujet de débat et nécessitent des études supplémentaires avant que des recommandations générales généralisées puissent être faites.
5. RÉHABILITATION - Adaptations et implications neurophysiologiques
Les altérations initiales de la voie afférente Ia semblent apparaître au cours des premières phases de la blessure et après la reconstruction. Cependant, les mesures de l'excitabilité spinale réflexe se normalisent au cours de la période de rééducation. Par conséquent, la blessure et la reconstruction chirurgicale contribuent probablement à des modifications immédiates de la voie réflexe Ia, qui se résorbent lorsque les symptômes aigus s'estompent et que la rééducation rétablit la fonction de l'articulation du genou et de la musculature environnante. Une revue systématique d'études largement transversales suggère une augmentation mesurable de l'excitabilité des réflexes spinaux chez les patients souffrant d’ACLR par rapport au membre non blessé et aux témoins, en particulier chez ceux qui sont plus éloignés de la chirurgie (>2 ans). Cependant, les déficits de l'excitabilité corticospinale et les altérations des schémas d'activation cérébrale, d'autre part, semblent émerger ou persister après le traitement. Ceci est inquiétant si l'on considère que les mesures de l'excitabilité corticospinale sont liées à la fonction musculaire et au handicap des patients. Notamment, les études de neuro-imagerie réalisées à ce jour, qui ont mis en évidence des différences dans les schémas d'activation neuronale cognitive, visuelle et sensorimotrice (Figure 1) chez les personnes ayant suivi une rééducation du LCA, se sont largement concentrées sur les patients ayant terminé une thérapie formelle. Ainsi, les approches de rééducation ne tiennent pas compte des adaptations du système nerveux central, voire les amplifient.
La neuroplasticité est régie non seulement par les changements de stimuli afférents secondaires à une lésion tissulaire, mais aussi par l'expérience secondaire à des changements de comportement, de nouvelles expériences ou un entraînement. La neuroplasticité dépendante de l'expérience peut être réparatrice, lorsque de nouveaux réseaux ou de nouvelles connexions sont formés dans le but de restaurer ou de maintenir une fonction, ou développementale, lorsque la formation synaptique et l’élagage se produisent pour apprendre ou affiner une compétence. Dans le contexte du mouvement, les deux principes sous-tendent les mécanismes de l'apprentissage moteur, le processus d'acquisition/amélioration de l'habileté motrice qui entraîne des changements relativement permanents dans la performance, ce qui est l'objectif de la réadaptation. Par conséquent, la neuroplasticité associée à la récupération motrice est probablement sensible aux nuances de l'approche rééducative. Par exemple, de nombreuses prescriptions d'exercices post ACLR sont fournies avec un feedback guidé de manière interne, où le patient est invité à diriger son attention vers le segment de mouvement. Lorsqu'un patient utilise une focalisation attentionnelle interne pendant l'exercice, il se concentre consciemment sur le mouvement de son corps. Des études de neuro-imagerie ont démontré qu'il existe des substrats neuronaux uniques pendant l'initiation et l'exécution du mouvement pour la focalisation attentionnelle interne et externe. Par conséquent, bien que les patients puissent retrouver leur fonction, les programmes moteurs sont développés avec un degré de contrôle conscient plus élevé que celui qui est généralement attribué au membre inférieur.
.
5.1. Implications cliniques - Nouvelles stratégies de rééducation
Les stratégies de rééducation qui 1) résolvent les déficits neurophysiologiques sous-jacents contribuant à l'inactivation/la faiblesse du quadriceps ou 2) améliorent le comportement de mouvement peuvent permettre d'améliorer les résultats globaux d’ACLR et de réduire le risque de nouvelle blessure. Une étude récente a fait état d'une efficacité modérée des interventions de rééducation courantes (par exemple, la cryothérapie et l'exercice) pour améliorer l'échec de l'activation du quadriceps post-ACLR (Sonnery-Cottet & al., 2019). D'autres stratégies incluent également l'utilisation de la stimulation électrique neuromusculaire qui fournit des méthodes exogènes pour augmenter l'activité du quadriceps. Ces interventions peuvent agir pour augmenter la stimulation afférente et ainsi exciter les interneurones Ia, ce qui entraîne l'excitation des motoneurones du quadriceps. Afin d'optimiser les fonctions au-delà de l'inhibition du quadriceps, comme le comportement moteur et la mécanique, il convient d'encourager de nouvelles méthodes de rééducation qui ciblent un large éventail de processus neuronaux en dehors de ceux spécifiques à la production de force maximale. Comme nous l'avons mentionné précédemment, les méthodes de prescription de la rééducation peuvent, dans une certaine mesure, conduire à une dépendance cognitive accrue pour le contrôle moteur chez les patients atteints d’ACLR.
L'augmentation des exigences corticales et attentionnelles après une blessure peut être une réponse compensatoire pour maintenir la stabilité de l'articulation mais aussi prédisposer les individus à se blesser à nouveau lors de tâches motrices complexes ou de situations exigeant une attention accrue comme le sport ou l'activité physique. L'utilisation de prescriptions d'exercices qui font appel à la focalisation attentionnelle interne peut être utile durant les premiers stades de la rééducation, mais limitée pour un transfert efficace des adaptations thérapeutiques au sport. Ainsi, les cliniciens qui incorporent progressivement des stratégies de focalisation attentionnelle externe qui demandent aux patients de diriger leur attention vers le résultat du mouvement ou l'environnement peuvent favoriser des améliorations dans la rétention et le transfert, l'automaticité du mouvement, augmentant ainsi l'engagement sous-cortical ou réduisant l'activité corticale (améliorant l'efficacité neuronale). Par conséquent, alors que les patients atteints d’ACLR bénéficient probablement d'exercices qui combinent la focalisation interne et externe, l'adoption de stratégies de focalisation attentionnelle externe au cours des dernières étapes de la thérapie peut améliorer la performance et cibler les adaptations du SNC induites par la blessure pendant le processus de récupération. De plus, des études biomécaniques et de neuro-imagerie ont suggéré que la perte de proprioception du genou suite à une blessure peut entraîner une réponse compensatoire visant à augmenter les ressources visuo-spatiales pour le contrôle du genou, par le biais d'un processus appelé repondération sensorielle. Tout comme l'augmentation des exigences attentionnelles, l'augmentation de la confiance visuelle peut constituer une stratégie pour maintenir la stabilité de l'articulation, mais échoue avec l'ajout de cibles visuelles multiples, ce qui est courant dans le sport. Par conséquent, l'utilisation de méthodes d'entraînement permettant de repondérer l'utilisation des informations visuelles par rapport à la proprioception peut constituer un moyen d'améliorer la stabilité articulaire dans un environnement sportif exigeant sur le plan visuel. Par exemple, l'entraînement stroboscopique, la double tâche utilisant l'interaction environnementale, ou l'ajout d'une obstruction visuelle peuvent être des compléments bénéfiques à la thérapie pour renforcer l'utilisation de la proprioception pour la programmation motrice. En l'absence d'études contrôlées randomisées, il reste difficile d'attribuer des approches spécifiques de réadaptation aux adaptations du SNC. Néanmoins, les données empiriques ont souligné l'importance de l'enseignement, de la focalisation attentionnelle et des principes d'apprentissage moteur chez les adultes en bonne santé, et les cliniciens devraient donc tenir compte de l'impact de la rééducation sur la neuroplasticité chez les patients après une lésion du LCA.
L'augmentation des exigences corticales et attentionnelles après une blessure peut être une réponse compensatoire pour maintenir la stabilité de l'articulation mais aussi prédisposer les individus à se blesser à nouveau lors de tâches motrices complexes ou de situations exigeant une attention accrue comme le sport ou l'activité physique. L'utilisation de prescriptions d'exercices qui font appel à la focalisation attentionnelle interne peut être utile durant les premiers stades de la rééducation, mais limitée pour un transfert efficace des adaptations thérapeutiques au sport. Ainsi, les cliniciens qui incorporent progressivement des stratégies de focalisation attentionnelle externe qui demandent aux patients de diriger leur attention vers le résultat du mouvement ou l'environnement peuvent favoriser des améliorations dans la rétention et le transfert, l'automaticité du mouvement, augmentant ainsi l'engagement sous-cortical ou réduisant l'activité corticale (améliorant l'efficacité neuronale). Par conséquent, alors que les patients atteints d’ACLR bénéficient probablement d'exercices qui combinent la focalisation interne et externe, l'adoption de stratégies de focalisation attentionnelle externe au cours des dernières étapes de la thérapie peut améliorer la performance et cibler les adaptations du SNC induites par la blessure pendant le processus de récupération. De plus, des études biomécaniques et de neuro-imagerie ont suggéré que la perte de proprioception du genou suite à une blessure peut entraîner une réponse compensatoire visant à augmenter les ressources visuo-spatiales pour le contrôle du genou, par le biais d'un processus appelé repondération sensorielle. Tout comme l'augmentation des exigences attentionnelles, l'augmentation de la confiance visuelle peut constituer une stratégie pour maintenir la stabilité de l'articulation, mais échoue avec l'ajout de cibles visuelles multiples, ce qui est courant dans le sport. Par conséquent, l'utilisation de méthodes d'entraînement permettant de repondérer l'utilisation des informations visuelles par rapport à la proprioception peut constituer un moyen d'améliorer la stabilité articulaire dans un environnement sportif exigeant sur le plan visuel. Par exemple, l'entraînement stroboscopique, la double tâche utilisant l'interaction environnementale, ou l'ajout d'une obstruction visuelle peuvent être des compléments bénéfiques à la thérapie pour renforcer l'utilisation de la proprioception pour la programmation motrice. En l'absence d'études contrôlées randomisées, il reste difficile d'attribuer des approches spécifiques de réadaptation aux adaptations du SNC. Néanmoins, les données empiriques ont souligné l'importance de l'enseignement, de la focalisation attentionnelle et des principes d'apprentissage moteur chez les adultes en bonne santé, et les cliniciens devraient donc tenir compte de l'impact de la rééducation sur la neuroplasticité chez les patients après une lésion du LCA.
5.2. Autres considérations - vulnérabilité psychologique et réponses protectrices aux blessures
Les stimuli douloureux qui sont perçus comme une menace imminente de danger suscitent des réponses protectrices de peur et d'anxiété qui encouragent respectivement un comportement de fuite ou d'évitement. Bien que ces réponses soient adaptatives dans le contexte de la douleur aiguë pour prévenir les lésions tissulaires, le modèle peur-évitement met en évidence la façon dont les signaux interoceptifs neutres qui sont temporairement associés à la douleur (par exemple, les informations proprioceptives) peuvent devenir des stimuli conditionnés qui captent également l'attention, suscitent la peur et motivent un comportement d'évitement. Dans le contexte d'une lésion du LCA, le catastrophisme et la kinésiopobie ont été associées à la performance fonctionnelle, aux taux de récidive et aux raisons de ne pas reprendre le sport. Par conséquent, la combinaison de la peur, de l'anxiété et des changements comportementaux associés (inutilisation et compensation biomécanique) peut se renforcer cycliquement et augmenter les adaptations des systèmes nerveux central et périphérique qui entraînent une déficience et une faiblesse fonctionnelles durables. De plus, la co-activation entre les régions motrices et émotionnelles peut expliquer en partie pourquoi une activité neuronale accrue dans les régions de la douleur (par exemple, l'aire somato-sensorielle secondaire) existe encore des années après la chirurgie et la rééducation ; cependant, les corrélats neuronaux des facteurs de vulnérabilité psychologique (par exemple, le catastrophisme, la kinésiophobie et l'hypervigilance envers les signaux internes) restent inconnus chez les personnes souffrant de lésions articulaires aiguës et méritent des recherches futures.
Alors que les facteurs de vulnérabilité psychologique entravent la guérison, les facteurs de protection psychologique tels que la résilience, l'optimisme et l'auto-efficacité peuvent favoriser la guérison grâce à des réponses cognitives, affectives et comportementales plus adaptées à la douleur et aux blessures. Plus précisément, la résilience à la douleur prédit de meilleurs résultats (fonction physique, intensité de la douleur, dépression), qui sont médiés par une plus grande auto-efficacité et une moindre kinésiophobie tandis que le catastrophisme de la douleur prédit de moins bons résultats qui sont médiés par une plus faible auto-efficacité et une plus grande kinésiophobie. L'importance des facteurs de vulnérabilité et de protection gagne également en importance dans la littérature sur l’ACLR, car de nouvelles preuves indiquent que des caractéristiques positives telles que l'optimisme, l'auto-efficacité et la motivation sont liées à une meilleure adhésion à la rééducation et à de meilleurs résultats fonctionnels. Étant donné le rôle que la vulnérabilité psychologique et les facteurs de protection peuvent jouer dans la réadaptation post ACLR, les approches thérapeutiques qui se sont avérées bénéfiques pour d'autres affections liées à la douleur doivent être envisagées dans le but de maximiser les résultats pour les patients. Par exemple, la thérapie cognitivo-comportementale diminue le catastrophisme et augmente l'auto-efficacité et la capacité d'adaptation, la thérapie d'exposition graduelle réduit efficacement la kinésiophobie ainsi que le catastrophisme, et la formation à la pleine conscience peut être utilisée pour améliorer la concentration externe et réduire la douleur chez les personnes présentant des niveaux élevés de catastrophisme de la douleur.
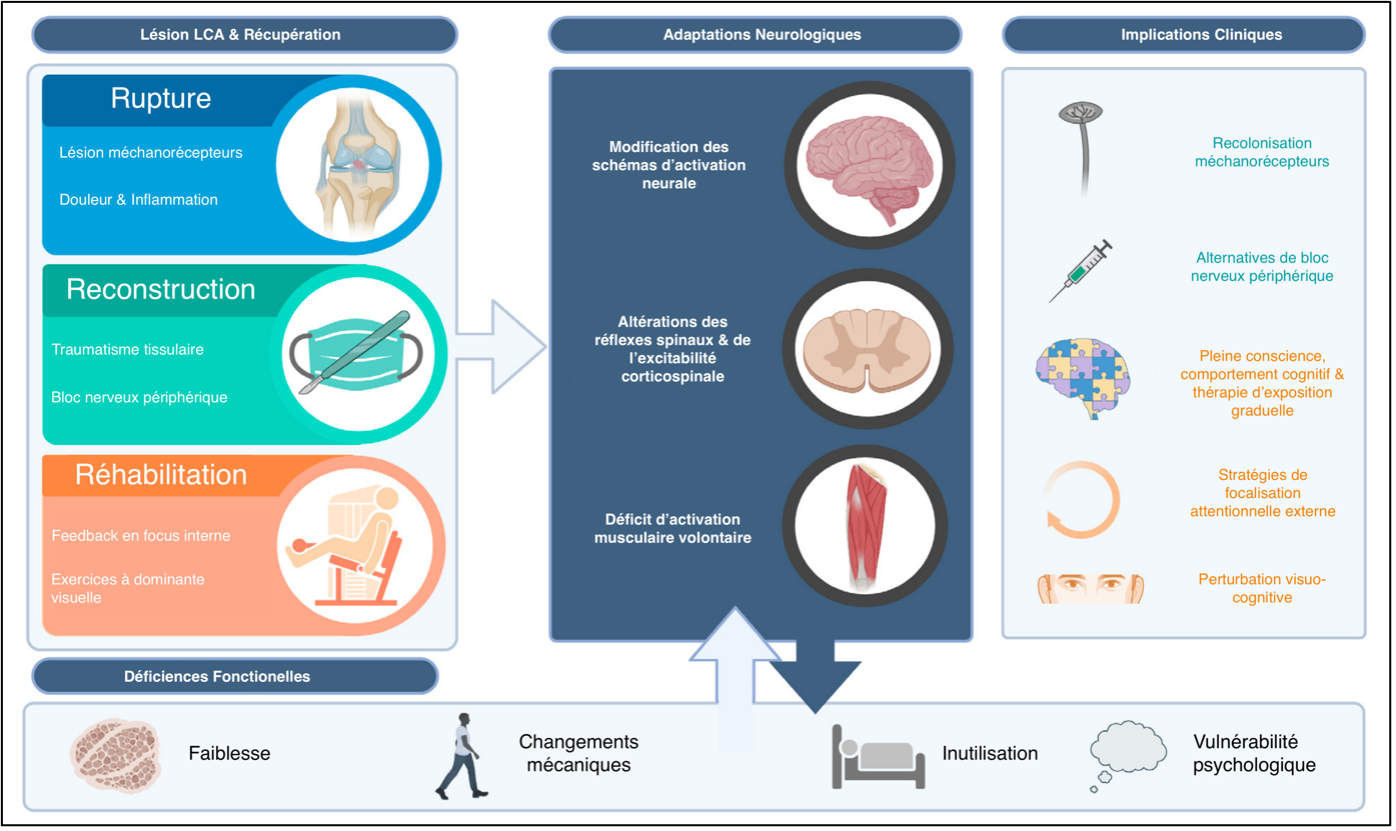
Traduction avec permission : Schematic describing mechanisms of neuroplasticity across anterior cruciate ligament injury, surgical reconstruction, and rehabilitation. Figure created with Biorender.com.
6. Limites et domaines de recherche future
Bien que le cadre conceptuel présenté ici bénéficie d'un soutien fondamental de la littérature existante, de nombreuses études neurophysiologiques sur les lésions du LCA ont jusqu'à présent été transversal et ont inclus des cohortes hétérogènes de participants du LCA-R. Ainsi, les caractéristiques des participants diffèrent d'une étude à l'autre en ce qui concerne le délai entre l'opération et la blessure, le niveau d'activité, les blessures concomitantes, le protocole de rééducation, le type de greffe et la fonction globale. Il y a également eu des variations dans les approches méthodologiques qui peuvent limiter l'inférence entre les études. En outre, les études de neuro-imagerie ont également varié en fonction de la tâche motrice, des corrections de débruitage de la tête et des seuils statistiques des groupes. À notre connaissance, toutes les études de neuro-imagerie se sont limitées à des études cas témoins et transversales, et on ne sait toujours pas si ces mesures neurales sont liées aux mesures cliniques post ACLR, comme la force musculaire ou l'état fonctionnel. De plus, il est nécessaire de mener des études neurophysiologiques multimodales à long terme pour différencier les sources d'adaptation du SNC à travers le spectre de soins d’ACLR.
Conclusion
La blessure du LCA induit une combinaison d'altérations neurophysiologiques au niveau du muscle, de la moelle épinière et du cerveau. La neuroplasticité peut être influencée par la blessure, le bien-être psychologique et la prise en charge médicale de ces patients. Les cliniciens doivent prendre en compte le rôle unique de la blessure, de la chirurgie, de l'anesthésie et de la rééducation sur les adaptations du SNC et les nouvelles stratégies potentielles pour atténuer la neuroplasticité inadaptée dans le continuum des soins. La mise en place de méthodes visant à préserver la fonction musculaire, à améliorer le bien-être psychologique, à rétablir la colonisation des mécanorécepteurs et à incorporer des stratégies de réadaptation pour promouvoir une rééducation neuromusculaire optimale peuvent être des options viables pour améliorer davantage les résultats de l’ACLR.
L'article
Criss, C. R., Melton, M. S., Ulloa, S. A., Simon, J. E., Clark, B. C., France, C. R., & Grooms, D. R. (2021). Rupture, reconstruction, and rehabilitation: A multi-disciplinary review of mechanisms for central nervous system adaptations following anterior cruciate ligament injury. The Knee, 30, 78–89. https://doi.org/10.1016/j.knee.2021.03.009
Nos articles de blog
Copyright © 2025
Write your awesome label here.



