L'implication potentielle du tissu conjonctif dans l'inconfort post-exercice des DOMS
Sep 14
/
Arnaud BRUCHARD
Le DOMS (Delayed onset muscle soreness) est un phénomène post-exercice fréquent qui se manifeste généralement après une charge intense et inhabituelle. Ses symptômes, qui comprennent la douleur et la raideur des tissus mous affectés, apparaissent quelques heures après l'activité et atteignent leur niveau maximal généralement après un à trois jours. Bien que tous les types de travail musculaire puissent induire un épuisement musculaire général, le DOMS est particulièrement causé par une contraction excentrique. Parmi les exemples connexes, citons la course en descente, les étirements balistiques, la plyométrie et les exercices de résistance excentrique. De multiples théories existent pour tenter d'expliquer les mécanismes conduisant au DOMS et la plupart d'entre elles suggèrent un rôle important du muscle squelettique (par exemple, une production excessive de lactate, une inflammation, des dommages structurels). Chez Kinesport, nous enseignons depuis 20 ans les lésions myo-aponévrotiques et expliquons les dommages structurels conjonctifs et des unions myo-collagéniques.
Nous tentons d’imager les constats structurels similaires entre le « macro » et le « micro »-scopique lors des courbatures et les LMA. Dans le prolongement, des recherches récentes suggèrent une contribution mécanique et/ou sensorielle substantielle du tissu conjonctif extramusculaire dans l’apparition des DOMS. Comme les stimuli optimaux nécessaires pour déclencher les adaptations du fascia profond sont sensiblement différents de ceux du muscle squelettique, cela peut avoir des implications importantes en ce qui concerne la prévention et le traitement des DOMS. Le présent article signé par Wilke et al. passent en revue les preuves disponibles décrivant l'implication possible du fascia profond dans ces douleurs retardées en post-contrainte excentrique. Nous vous en proposons une synthèse traduction.
Modèles pathogéniques classiques
L'une des plus anciennes théories décrivant le mécanisme possible du DOMS se concentre sur l'accumulation d'acide lactique. Bien qu'il existe des preuves suggérant que l'activation des récepteurs par des métabolites peut être impliquée dans une certaine mesure dans la fatigue musculaire pendant un exercice intense, la théorie de l'acide lactique a été largement rejetée comme cause du DOMS.
Il y a presque 120 ans, Hough (Hough, T. Ergographic studies in muscular soreness. Am. J. Physiol. 1902, 7, 76–92) a proposé pour la première fois la théorie selon laquelle le phénomène de DOMS pourrait résulter de dommages structurels au sein du muscle squelettique. Il a été affirmé à plusieurs reprises que des contraintes mécaniques élevées imposées aux tissus mous pouvaient dépasser la capacité de charge du sarcomère, entraînant des micro-ruptures situées dans ou près du disque Z. En fait, de tels changements ont régulièrement été identifiés lors d'examens microscopiques de biopsies prélevées après des contractions excentriques non habituelles. Le streaming de la ligne Z (streaming z-disk) affecte plus fréquemment les fibres musculaires à contraction rapide de type II que les fibres musculaires à contraction lente de type I. Comparées aux fibres de type I, les fibres de type II à contraction rapide ont des disques en Z plus étroits et plus faibles et des filaments de titine moins souples, ce qui pourrait entraîner des contraintes mécaniques plus importantes pendant la contraction excentrique. En outre, ils contiennent des isoformes plus petites de la protéine de stabilisation des sarcomères, la nébuline, ce qui pourrait les rendre plus sensibles aux dommages induits par les contraintes. Tous ces facteurs, agissant de concert, expliquent probablement pourquoi les muscles avec un grand contenu en fibres de type II subissent plus de dommages lors d'une contraction excentrique que ceux avec un grand contenu en fibres de type I. Cependant, certains auteurs interprètent les changements structurels intracellulaires microscopiques après une contraction excentrique comme une partie naturelle du processus de remodelage plutôt que comme un signe de dommage musculaire.
Il y a presque 120 ans, Hough (Hough, T. Ergographic studies in muscular soreness. Am. J. Physiol. 1902, 7, 76–92) a proposé pour la première fois la théorie selon laquelle le phénomène de DOMS pourrait résulter de dommages structurels au sein du muscle squelettique. Il a été affirmé à plusieurs reprises que des contraintes mécaniques élevées imposées aux tissus mous pouvaient dépasser la capacité de charge du sarcomère, entraînant des micro-ruptures situées dans ou près du disque Z. En fait, de tels changements ont régulièrement été identifiés lors d'examens microscopiques de biopsies prélevées après des contractions excentriques non habituelles. Le streaming de la ligne Z (streaming z-disk) affecte plus fréquemment les fibres musculaires à contraction rapide de type II que les fibres musculaires à contraction lente de type I. Comparées aux fibres de type I, les fibres de type II à contraction rapide ont des disques en Z plus étroits et plus faibles et des filaments de titine moins souples, ce qui pourrait entraîner des contraintes mécaniques plus importantes pendant la contraction excentrique. En outre, ils contiennent des isoformes plus petites de la protéine de stabilisation des sarcomères, la nébuline, ce qui pourrait les rendre plus sensibles aux dommages induits par les contraintes. Tous ces facteurs, agissant de concert, expliquent probablement pourquoi les muscles avec un grand contenu en fibres de type II subissent plus de dommages lors d'une contraction excentrique que ceux avec un grand contenu en fibres de type I. Cependant, certains auteurs interprètent les changements structurels intracellulaires microscopiques après une contraction excentrique comme une partie naturelle du processus de remodelage plutôt que comme un signe de dommage musculaire.
En outre, la manière dont ces microtraumatismes devraient être associés à la douleur n'est toujours pas claire. Nosaka et al. ont demandé à des participants masculins d'effectuer des séries d'exercices excentriques avec un nombre de répétitions variable. Bien que l'induction du DOMS ait été réussie, la douleur ressentie lors du mouvement et de la palpation n'a pas été corrélée avec la créatine kinase plasmatique, qui est un marqueur de dommages musculaires. Des résultats similaires ont été obtenus par Nurenberg et al qui n'ont trouvé qu'une faible corrélation entre le degré de DOMS et le degré de lésion ultrastructurale des tissus analysés par micrographie électronique.
Un troisième ensemble de théories se concentre sur les processus inflammatoires. Contrairement aux dommages corporels, une activation retardée et soutenue des afférences de type III peut être induite par un gonflement intramusculaire associé à l'inflammation, qui exerce une pression sur les récepteurs mécanosensibles. Cette hypothèse est étayée par l'observation que le gonflement maximal coïncide avec le pic de DOMS post-exercice. En outre, l'inflammation pourrait entraîner une augmentation de la perception de la douleur par la libération de substances modulant la douleur (comme la PGE2) par les cellules inflammatoires qui envahissent le tissu musculaire endommagé. On suppose que les cellules inflammatoires, qui pénètrent dans le tissu endommagé, sont guidées par chimiotaxie (mouvement des cellules immunitaires vers des substances qui sont libérées par les cellules endommagées) vers le site par des substances qui se diffusent dans le plasma et l'espace interstitiel. Il est intéressant de noter qu'il existe un lien possible entre l'inflammation et la théorie des lésions musculaires microscopiques mentionnées précédemment.
Les charges mécaniques élevées ne semblent pas seulement causer des dommages aux éléments contractiles des fibres musculaires, mais aussi aux membranes. La modification de la perméabilité membranaire qui en résulte pourrait être à l'origine de la libération de substances chimiotactiques. Cette hypothèse correspond à la première théorie d'Armstrong sur les mécanismes à l'origine du DOMS. Il a émis l'hypothèse que les dommages membranaires résultant de forces mécaniques élevées entraînent un afflux incontrôlé de calcium depuis l'espace interstitiel, ce qui active des protéases et des phospholipases dépendantes du calcium qui exacerbent encore les dommages membranaires. Selon sa théorie, ce processus est amplifié par le fait que le calcium s'accumule dans les mitochondries, affectant la respiration cellulaire et donc la synthèse d'ATP et réduisant finalement le retour actif du calcium dans le réticulum sarcoplasmique. Les lésions membranaires entraînent en outre un flux de composants intracellulaires, tels que des enzymes, dans l'espace intercellulaire et attirent ainsi les monocytes qui se transforment en macrophages. Les mastocytes et les histocytes sont activés et on pense que l'accumulation de substances chimiques résultant de la phagocytose et de la nécrose active les terminaisons nerveuses libres qui déclenchent la douleur. Cependant, certains auteurs ont contesté l'existence d'une lésion ou d'une inflammation du sarcolemme induite par l'exercice, car aucune lésion du sarcolemme n'a pu être trouvée après des contractions excentriques malgré la présence d'un DOMS sévère. Ceci est soutenu par d'autres auteurs qui n'ont trouvé que des preuves très faibles ou inexistantes d'inflammation et de nécrose dans les muscles après des dommages musculaires induits par l'exercice. Certains auteurs spéculent même que l'inflammation observée dans les muscles squelettiques humains après l'exercice pourrait plutôt représenter un artefact méthodologique qu'un véritable événement induit par l'exercice, en raison de la nature invasive de l'échantillonnage musculaire.
Les charges mécaniques élevées ne semblent pas seulement causer des dommages aux éléments contractiles des fibres musculaires, mais aussi aux membranes. La modification de la perméabilité membranaire qui en résulte pourrait être à l'origine de la libération de substances chimiotactiques. Cette hypothèse correspond à la première théorie d'Armstrong sur les mécanismes à l'origine du DOMS. Il a émis l'hypothèse que les dommages membranaires résultant de forces mécaniques élevées entraînent un afflux incontrôlé de calcium depuis l'espace interstitiel, ce qui active des protéases et des phospholipases dépendantes du calcium qui exacerbent encore les dommages membranaires. Selon sa théorie, ce processus est amplifié par le fait que le calcium s'accumule dans les mitochondries, affectant la respiration cellulaire et donc la synthèse d'ATP et réduisant finalement le retour actif du calcium dans le réticulum sarcoplasmique. Les lésions membranaires entraînent en outre un flux de composants intracellulaires, tels que des enzymes, dans l'espace intercellulaire et attirent ainsi les monocytes qui se transforment en macrophages. Les mastocytes et les histocytes sont activés et on pense que l'accumulation de substances chimiques résultant de la phagocytose et de la nécrose active les terminaisons nerveuses libres qui déclenchent la douleur. Cependant, certains auteurs ont contesté l'existence d'une lésion ou d'une inflammation du sarcolemme induite par l'exercice, car aucune lésion du sarcolemme n'a pu être trouvée après des contractions excentriques malgré la présence d'un DOMS sévère. Ceci est soutenu par d'autres auteurs qui n'ont trouvé que des preuves très faibles ou inexistantes d'inflammation et de nécrose dans les muscles après des dommages musculaires induits par l'exercice. Certains auteurs spéculent même que l'inflammation observée dans les muscles squelettiques humains après l'exercice pourrait plutôt représenter un artefact méthodologique qu'un véritable événement induit par l'exercice, en raison de la nature invasive de l'échantillonnage musculaire.
Enfin, les radicaux libres sont également cités à plusieurs reprises comme une raison pour laquelle la membrane des fibres musculaires est endommagée. Le fait qu'ils soient produits pendant la contraction excentrique n'est pas controversé car de nombreuses études ont montré ce lien jusqu'à présent. Cependant, il n'est pas clair si les radicaux libres sont liés de manière causale au développement de dommages membranaires induits par l'exercice et au DOMS. Entre autres facteurs, la composante temporelle s'oppose à un tel lien. Close et al. ont démontré que l'augmentation des radicaux libres ne s'est produite que 24-48 heures après le DOMS maximal. De plus, l'administration d'antioxydants a eu peu ou pas d'effet sur la douleur. Ceci est soutenu par De Oliveira et ses collègues qui ont trouvé qu'une supplémentation en vitamines antioxydantes prévenait le stress oxydatif mais pas le DOMS.
En résumé, les modèles pathogéniques classiques centrés sur le tissu musculaire ne sont pas en mesure d'expliquer les symptômes du DOMS couramment observés après des contractions excentriques non habituelles.
.
Implication possible du tissu conjonctif
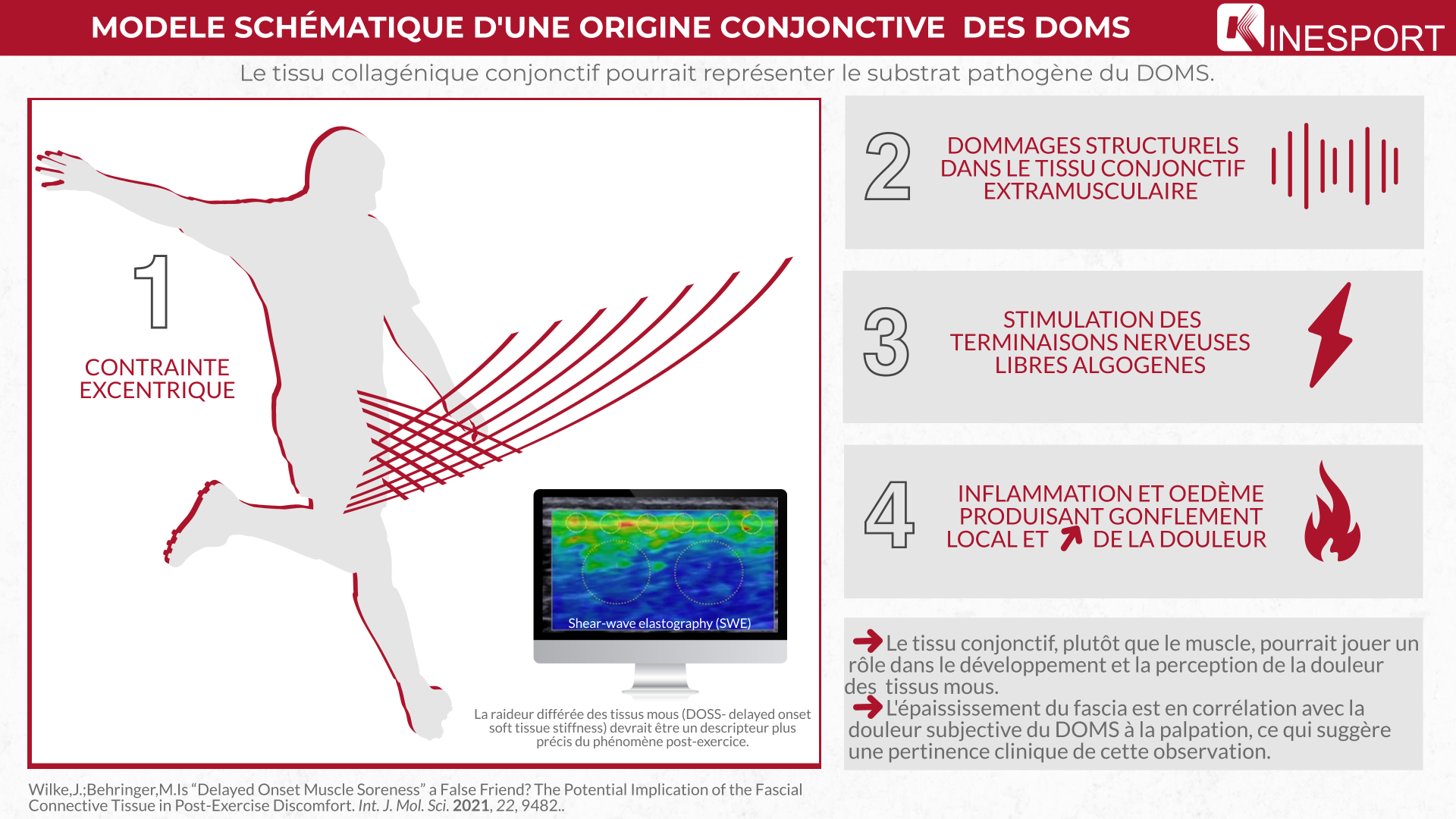
Un récent courant de recherche suggère que le tissu collagénique conjonctif pourrait représenter le substrat pathogène du DOMS. Sur la base des preuves disponibles, les caractéristiques architecturales et la capacité sensorielle du fascia peuvent être à l'origine de l'inconfort post-exercice perçu.
Dommages structurels : Anatomie du fascia
Dommages structurels : Anatomie du fascia
S'il n'est pas disséqué chez les cadavres ou endommagé lors d'une intervention chirurgicale, le tissu collagénique conjonctif est inextricablement lié au muscle squelettique. Au niveau micro, la fibre musculaire fusionne étroitement avec l'endomysium. Il est intéressant de noter que jusqu'à 70 % des fibres musculaires fusionnent étroitement avec l'endomysium et que jusqu'à 70 % des fibres musculaires ne couvrent pas toute la distance entre l'insertion et l'origine ce qui a donné les explorations sur les données architecturales. Pourtant, comme les endomysiums des fibres adjacentes sont structurellement connectés, ils peuvent aussi transmettre la force par cisaillement translaminaire. Tout comme l'endomysium, le périmysium ne représente pas seulement une enveloppe pour les faisceaux de fibres musculaires. Il forme plutôt un réseau de tubes collagènes en forme de nid d'abeille avec une continuité tissulaire directe. Cela a des implications pratiques car il a été démontré que la toile périmysiale transmet une force radiale lors d'une charge mécanique. Enfin, il a été démontré que le fascia profond présente des expansions fibreuses directes qui fusionnent avec le muscle squelettique sous-jacent, ce qui signifie que la contraction musculaire peut le mettre en tension de manière sélective. En plus d'être structurellement connecté au muscle sous-jacent, le fascia fournit également un lien direct avec d'autres muscles disposés parallèlement ou en série. On peut donc supposer que toute activité ou charge musculaire aura des effets mécaniques prononcés sur le tissu conjonctif.
Le phénomène de DOMS se produit principalement lors d'une charge excentrique, et pendant cet allongement actif, des forces de déformation élevées agissent sur le muscle squelettique. D'un point de vue fonctionnel, les continuités décrites dans les tissus mous collagéniques peuvent représenter un amortisseur de chocs absorbant des forces excessives potentiellement dommageables pour le muscle squelettique. Cependant, si l'on dépasse la capacité de charge, des dommages microscopiques ou macroscopiques peuvent se produire dans l'endomysium, le périmysium ou le fascia profond. Suivant ce paradigme, certaines études ont examiné la morphologie et l'intégrité du tissu collagénique conjonctif pendant la charge ou après l'induction du DOMS.
Preuves spécifiques au DOMS
Malgré leur dénomination, les lésions musculaires affectent rarement uniquement le tissu musculaire. Dans environ 90 % des cas, le site réel de la lésion est situé soit dans la jonction musculotendineuse, soit dans le fascia extramusculaire. Comme le DOMS, les lésions musculaires surviennent fréquemment après une charge excentrique active excessive, et les deux peuvent donc présenter une implication similaire du tissu conjonctif. Il est intéressant de noter qu'il existe des preuves convaincantes de l'existence de dommages structurels de la matrice extracellulaire dans le DOMS. Par exemple, Brown et al. ont demandé à leurs participants d'effectuer 50 contractions excentriques maximales des extenseurs du genou. Des taux urinaires accrus d'hydroxyproline et d'hydroxylysine, suggérant une dégradation du tissu conjonctif, ont été mesurés immédiatement ainsi que deux jours après l'activité. Dans une expérience plus récente, 24 à 72 heures après l'induction du DOMS, Mavropilas et al ont trouvé des élévations d'hydroxyproline allant jusqu'à 53%. Cependant, il est intéressant de noter que, tout comme l'absence de corrélation avec les marqueurs de dommages musculaires, les changements observés n'étaient pas associés à l'ampleur du DOMS perçu. Il est donc urgent de mener des recherches supplémentaires pour clarifier la relation entre les dommages structurels du tissu conjonctif et la douleur liée au DOMS. Raastad et al. ont examiné des biopsies de tissus prélevés dans le muscle vaste latéral de volontaires sains ayant effectué un total de 300 contractions excentriques maximales des extenseurs du genou. Les jours suivant l'exercice, l'immunoréactivité de deux marqueurs du remodelage de la matrice extracellulaire était fortement augmentée. Dans une expérience récente, Tenberg et al. ont examiné la morphologie et la mécanique du fascia après un exercice excentrique et concentrique épuisant des fléchisseurs du coude. Contrairement à la charge concentrique, qui n'entraîne pas de DOMS, l'épaisseur du fascia brachial a augmenté les jours suivant un exercice excentrique. Il est important de noter que l'épaississement du fascia est en corrélation avec la douleur subjective du DOMS à la palpation, ce qui suggère une pertinence clinique de cette observation. Outre une accumulation d'acide hyaluronique, l'augmentation de l'épaisseur du fascia pourrait particulièrement refléter l'œdème et l'inflammation résultant d'une lésion du tissu fascial. Des changements ont également été observés dans la mobilité des tissus. Alors que le déplacement musculaire lors d'un mouvement articulaire passif était plus important après les excentriques, la mobilité du fascia est restée inchangée. Des recherches supplémentaires sont justifiées afin de juger si une incapacité du fascia à suivre le mouvement du muscle a une valeur pathogène dans la DOMS. En résumé, les preuves disponibles suggèrent l'existence de changements morphologiques dans le tissu conjonctif extramusculaire, dont certains sont directement liés à l'inconfort subjectif.
Existence de dommages structurels de la matrice extracellulaire dans le DOMS
L'épaississement du fascia est en corrélation avec la douleur subjective du DOMS à la palpation, ce qui suggère une pertinence clinique de cette observation.
Le déplacement musculaire lors d'un mouvement articulaire passif était plus important après les excentriques, la mobilité du fascia est restée inchangée.
Contribution sensorielle : Physiologie du fascia
Il est suggéré que le fascia contribue substantiellement à la proprioception et à la douleur en raison de son riche équipement en récepteurs sensoriels. Plus précisément, des analyses histologiques ont confirmé l'existence de corpuscules de Ruffini, de Pacini et de terminaisons nerveuses libres. Comme une partie substantielle des fibres identifiées a été signalée comme étant positive pour la substance P et le peptide lié au gène de la calcitonine (CGRP), on doit supposer une capacité algogène d'au moins certaines terminaisons nerveuses libres. Barry et al. ont comparé la densité des fibres nerveuses de différents tissus lombaires chez les rongeurs, rapportant une présence trois fois plus importante dans le fascia que dans le muscle.
En raison de son innervation sensorielle, il a été suggéré que le fascia représente un générateur potentiel de douleur cliniquement pertinent. Taguchi et al. ont appliqué des stimuli mécaniques, chimiques et thermiques au fascia crural de rat. Le pincement répétitif avec une pince d'horloger aiguisée a augmenté la production d’un gène exprimé dans les neurones, qui reflète l'activation neuronale liée à la douleur. L'irritation du fascia au moyen d'une boule de coton imbibée de bradykinine a entraîné une augmentation lente des taux de décharge dans 13 des 23 fibres testées transportant des informations sensorielles (par exemple, nociceptives). Alors que seules quelques fibres ont répondu à l'application de froid, la chaleur a déclenché l'activité de plus de la moitié des fibres. Dans une autre expérience, Schilder et al. ont injecté une solution saline hypertonique dans le tissu sous-cutané, le fascia profond et les muscles de la région du bas du dos. L'irritation chimique des structures non-musculaires a provoqué des sensations de douleur plus durables (~15 contre ~10 min) et plus fortes que l'injection musculaire. Deising et al. ont réalisé une étude similaire en stimulant différents tissus lombaires au moyen du facteur de croissance des nerfs, dont l'injection évoque une hyperalgie locale. Après l'expérience, des sensibilisations durables à la stimulation mécanique et chimique (jusqu'à deux semaines) ont été observées au niveau du fascia. Ceci est intéressant car les plaintes du DOMS peuvent persister pendant plusieurs jours.
La plus grande sensibilité du fascia aux stimuli nocifs ne s'applique pas seulement aux agents chimiques. Toujours en ciblant la région du bas du dos, Schilder et al. ont montré que le même schéma de réponse (sensation de douleur plus forte en cas d'irritation du fascia par rapport à l'irritation musculaire) se produit en cas de stimulation électrique. En plus de présenter une forte sensibilité générale à la douleur, le fascia semble répondre fortement à une inflammation locale. Hoheisel & Mense ont injecté l'adjuvant complet de Freund dans le fascia thoracolombaire de rat, provoquant une réponse inflammatoire. Il est intéressant de noter que 11 % des neurones au niveau L3, qui ne répondent normalement pas à l'entrée du fascia lombaire, sont devenus actifs. En outre, certaines cellules nerveuses présentaient de nouveaux champs réceptifs.
Dans l'ensemble, les données disponibles suggèrent que le tissu conjonctif, plutôt que le muscle, pourrait jouer un rôle dans le développement et la perception de la douleur des tissus mous.
Dans l'ensemble, les données disponibles suggèrent que le tissu conjonctif, plutôt que le muscle, pourrait jouer un rôle dans le développement et la perception de la douleur des tissus mous.
Preuves liées au DOMS
Gibson et al. ont demandé à un échantillon de 13 jeunes adultes en bonne santé d'effectuer un protocole de charge excentrique pour le muscle tibialis anterior d'une jambe. Un jour après l'induction du DOMS, une solution saline hypertonique a été injectée dans le muscle tibialis anterior et son fascia profond. Dans la jambe de contrôle non exercée, l'irritation du fascia était plus douloureuse (+42%) que la stimulation du tissu musculaire, ce qui concorde avec les résultats ci-dessus de Schilder et ses collègues. Le même schéma (douleur plus élevée lors de l'injection du fascia) a été trouvé dans la jambe exercée, cependant, il y avait une différence marquée. Alors que la douleur consécutive à l'irritation musculaire était identique à celle de la jambe témoin, la stimulation du fascia était 39 % plus douloureuse. Cela signifie que le fascia profond, mais pas le muscle squelettique, devient plus sensible aux stimuli chimiques nocifs en présence du DOMS. Dans l'étude de Lau et al. , dix jeunes hommes ont effectué 10 × 6 contractions excentriques isocinétiques maximales des fléchisseurs non-dominants du coude afin d'induire un DOMS. Les jours suivants, les auteurs ont mesuré le seuil de douleur électrique en utilisant l'imagerie ultrasonore et des électrodes à aiguille. Conformément aux résultats précédents, les changements d'intensité de la douleur étaient plus élevés pour le biceps brachial et le fascia brachial que pour le muscle squelettique 48 heures après l'exercice. Alors que les changements de sensibilité du fascia lors de la stimulation électrique n'étaient pas associés à la douleur à la palpation, une corrélation modérée à forte existait avec le seuil de douleur mécanique (r = 0,63-0,87).
Implications pratiques et perspectives de recherche future
Jusqu'à présent, la majorité des recherches disponibles sur le DOMS ont été consacrées à l'étude des muscles squelettiques. Par exemple, l'élastographie par ondes de cisaillement représente une méthode prometteuse et simple pour quantifier la rigidité mécanique des tissus mous. En ce qui concerne le DOMS, son application est particulièrement intéressante car elle permet d'évaluer clairement la différenciation des structures (c'est-à-dire le muscle par rapport au fascia). Agten et al. ont examiné un échantillon de 10 volontaires les jours suivant un exercice excentrique lourd des fléchisseurs du coude. La vitesse des ondes de cisaillement (un substitut de la rigidité mécanique), mesurée exclusivement à l'intérieur des muscles, a augmenté immédiatement après l'exercice mais est revenue à la ligne de base vers le deuxième jour. Cependant, comme les niveaux de douleur subjective ont atteint leur maximum le troisième jour, une relation causale avec le DOMS semble improbable. Dans cette optique et compte tenu de l'accumulation de preuves sur l'implication potentielle du fascia, les études futures devraient utiliser des méthodes basées sur l'imagerie pour étudier les changements morphologiques et mécaniques (c'est-à-dire la rigidité et l'élasticité) du fascia profond (Figure 2).
En plus d'aider à clarifier la pathophysiologie sous-jacente au DOMS, se concentrer sur le tissu collagénique conjonctif pourrait ouvrir de nouvelles voies pour son traitement. Selon une revue systématique avec méta-analyse de Dupuy et al, la récupération active, le massage, l'utilisation de vêtements de compression, l'immersion, la thérapie par eau contrastée et la cryothérapie sont efficaces pour améliorer les plaintes du DOMS.
En plus d'aider à clarifier la pathophysiologie sous-jacente au DOMS, se concentrer sur le tissu collagénique conjonctif pourrait ouvrir de nouvelles voies pour son traitement. Selon une revue systématique avec méta-analyse de Dupuy et al, la récupération active, le massage, l'utilisation de vêtements de compression, l'immersion, la thérapie par eau contrastée et la cryothérapie sont efficaces pour améliorer les plaintes du DOMS.
- En supposant la présence de dommages structurels dans le fascia profond du muscle squelettique, l'apport opportun de matériaux de construction pour la réparation des tissus devrait être crucial pour la récupération. Il a été démontré que l'administration orale de gélatine augmente la concentration des acides aminés : glycine, proline, hydroxyproline et hydroxilysine, qui sont d'une importance essentielle pour la production de collagène. En outre, la consommation de gélatine a entraîné une multiplication par deux du peptide N-terminal du pro-collagène I (PINP), ce qui indique une plus forte production de collagène. Dans un essai en double aveugle, randomisé et contrôlé, 24 hommes adultes actifs ont reçu un placebo ou 20 g de peptides de collagène par jour pendant une semaine avant et 48 heures après un protocole de fatigue avec 150 sauts. Deux jours après l'exercice, l'ampleur du DOMS était sensiblement plus faible dans le groupe travail (90,4 vs 125,7 mm sur une échelle visuelle analogique, d = 2,6) par rapport au groupe placebo. De plus, les personnes ayant reçu une supplémentation en gélatine ont rétabli les diminutions de la hauteur de saut en contre-mouvement (une mesure de la force explosive des jambes inférieures) plus rapidement que les participants ayant reçu un placebo (90 % contre 79 % de la performance de base au deuxième jour). Dans des essais futurs, il faudrait évaluer si une supplémentation chronique en collagène peut prévenir ou réduire davantage le DOMS et si différentes doses peuvent modifier l'effet observé dans cet essai exploratoire initial.
- Le foam rolling, une forme intensive d'auto-massage avec des outils en polypropylène, représente une autre méthode prometteuse pour traiter les altérations fasciales après un exercice intense. Krause et al. ont démontré qu'une séance aiguë de « roulage » de la cuisse réduit la sensibilité à la douleur tout en améliorant les capacités de glissement relatives des différentes couches fasciales. L'altération du glissement intrafascial, qui est normalement assuré par la présence d'acide hyaluronique, a été associée à l'apparition de la douleur. Il est possible que l'amélioration du glissement intrafascial puisse expliquer pourquoi le roulage diminue la douleur des tissus mous et le DOMS.
- Des recherches supplémentaires pourraient combiner des évaluations spécifiques des composants des tissus fasciaux et musculaires (par exemple, en utilisant l'imagerie par ultrasons et l'élastographie, voir la figure 2) ainsi que des évaluations subjectives de la douleur après des traitements par roulement.
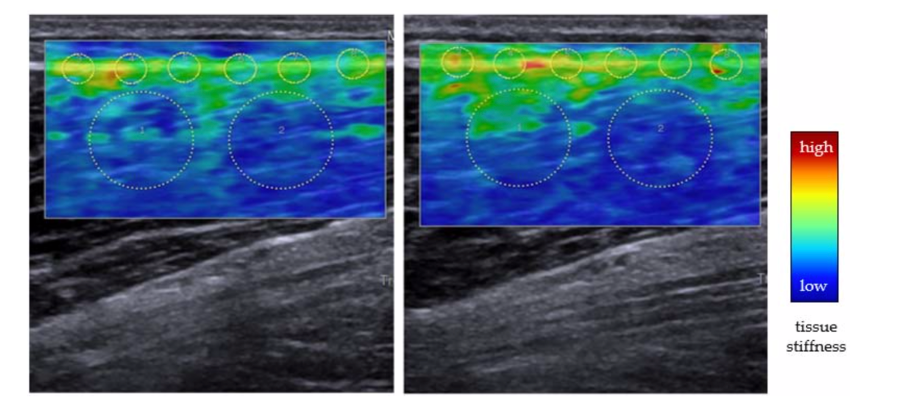
Figure 2 : Élastographie par ondes de cisaillement (SWE) de la cuisse avant (gauche) et 48 h (droite) après un exercice excentrique. Dans la SWE, une impulsion de force de radiation acoustique est utilisée pour produire des ondes de cisaillement se déplaçant perpendiculairement. La mesure de la vitesse de propagation de ces ondes de cisaillement horizontale permet de calculer les propriétés mécaniques. Les régions colorées d'intérêt indiquent la rigidité mécanique du tissu : alors que le bleu représente des valeurs faibles, le rouge représente des valeurs élevées. Notez l'augmentation marquée de la rigidité dans et près du fascia profond sur le muscle (petits cercles). Les scans utilisés pour cette figure ont été acquis dans le laboratoire des auteurs
Alors que la supplémentation en collagène et le foam rolling représentent des stratégies relativement passives pour déclencher des adaptations des tissus mous, les professionnels de la santé peuvent envisager de concevoir des paradigmes d'exercices spécifiques visant à augmenter la tolérance du fascia à l'allongement sous charge. Outre l'entraînement excentrique régulier et la plyométrie, cela peut notamment inclure des étirements dynamiques multidirectionnels à des vitesses variables. Cependant, bien qu'il ait été démontré que le tissu conjonctif s'adapte de manière substantielle aux stimuli mécaniques, les études portant spécifiquement sur l'impact de l'exercice sur la morphologie et la mécanique du fascia profond sont encore rares.
Les forces de tension associées à la contraction excentrique peuvent provoquer des micro-ruptures et une inflammation du fascia profond.
Les auteurs proposent que la raideur différée des tissus mous (DOSS- delayed onset soft tissue stiffness) soit un descripteur plus précis du phénomène post-exercice.
Le foam rolling et la supplémentation en peptides de collagène peuvent représenter des options prometteuses pour soulager l'inconfort post-exercice.
Conclusion
- Bien que les théories expliquant la pathogenèse du DOMS se soient longtemps concentrées sur le muscle squelettique, des preuves de plus en plus nombreuses suggèrent un rôle prépondérant du tissu collagénique conjonctif.
- D'après la littérature disponible, les forces de tension associées à la contraction excentrique peuvent provoquer des micro-ruptures et une inflammation du fascia profond.
- Comme la recherche expérimentale démontre clairement que le fascia est plus sensible à la douleur que le muscle après une irritation chimique, thermique, électrique et mécanique, les auteurs proposent que la raideur différée des tissus mous (DOSS- delayed onset soft tissue stiffness) soit un descripteur plus précis du phénomène post-exercice.
- Actuellement, il y a encore un manque d'études examinant les approches spécifiques au fascia pour la prévention et le traitement de la DOSS. Cependant, les premières données suggèrent que le foam rolling et la supplémentation en peptides de collagène peuvent représenter des options prometteuses pour soulager l'inconfort post-exercice.
- Les professionnels s’occupant des sportifs peuvent donc modifier les approches précédentes conçues pour prévenir et traiter le DOSS, en fournissant désormais des stimuli plus spécifiques pour le fascia profond.
Copyright © 2026
Write your awesome label here.



