sLe muscle est un organe métaboliquement actif qui nécessite un apport suffisant d'oxygène, de nutriments et de facteurs de croissance véhiculés par le sang. Il est également remarquablement dynamique, présentant une plasticité et une capacité de régénération, et est capable de s'adapter à une variété de stimuli.
La plasticité du muscle squelettique est en partie due à l'activité du pool de cellules souches résidant dans le muscle, appelées "cellules satellites" (SC). Depuis leur découverte initiale, les cellules satellites musculaires ont été largement étudiées pour leur contribution à la régénération du muscle squelettique, au maintien de la masse musculaire, à l'adaptation à l'effort et à une variété de maladies.
Ces cellules, généralement quiescentes "au repos", sont activées après un stimulus tel qu'une lésion musculaire. Le programme myogénique des CS est régi par la régulation à la hausse ou à la baisse du facteur de transcription 7 (Pax7) et d'un réseau transcriptionnel appelé facteurs de régulation myogénique. Les SCs musculaires sont la principale source de nouveaux myonucléus pendant les périodes d'adaptation, de réparation ou de régénération et ont la capacité de s'auto-renouveler pour maintenir leur population basale. Cette capacité des SCs musculaires à s'auto-renouveler et à retourner à un état de quiescence, entre le sarcolemme et la lame basale, est un aspect clé de la "souche" et une condition pour la préservation de la capacité de régénération. Il a été démontré que l'orchestration du programme myogénique et des facteurs transcriptionnels associés est influencée de manière extensive par une pléthore de cytokines et de facteurs de croissance. Près de la "niche" SC anatomique du muscle, mais à l'extérieur de la lame basale, se trouvent des capillaires composés d'une monocouche de cellules endothéliales (ECs), souvent avec des cellules contractiles péricapillaires appelées péricytes. Le muscle squelettique est hautement vascularisé, avec des myofibres individuelles entrelacées avec un réseau extensif de microvaisseaux. Ce réseau réagit en faisant correspondre les augmentations de la demande énergétique et métabolique à une augmentation du flux sanguin pour faciliter l'élimination des métabolites et l'apport d'oxygène et de nutriments. Outre ce rôle critique, il existe de plus en plus de preuves de l'association spatiale proche et de l'inter-action entre les SCs musculaires et le réseau microvasculaire. L'interaction entre le SC musculaire et les capillaires, les ECs locaux et les péricytes peut jouer un rôle critique dans la distribution de ces facteurs nécessaires à la fonction optimale des cellules souches SC - et représente un intérêt croissant dans le domaine de la physiologie du muscle et de l'exercice.
Les auteurs, ici, émettent l'hypothèse qu'une capillarisation réduite des myofibres peut être un facteur limitant pour une fonction optimale des SC et ainsi limiter la plasticité musculaire chez les jeunes adultes et les adultes âgés en bonne santé après l'exercice. L'étroite proximité spatiale et la relation anatomique entre le SC et les ECs du muscle peuvent être altérées avec le vieillissement (décrites dans la Fig. 1).
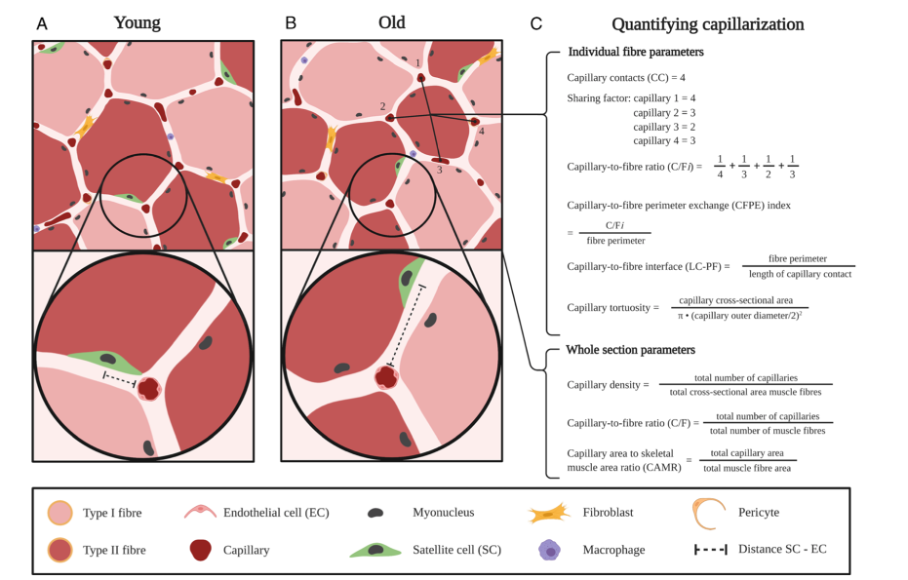
Figure 1. Représentation d'une section transversale de fibre musculaire chez un jeune individu (A) et plus âgé (B). Après un stimulus tel que l'exercice ou une lésion myofibrillaire, les SCs sortent de l'état quiescent et s'activent, prolifèrent et se différencient en fusionnant avec la fibre musculaire endommagée. La section transversale d'une fibre musculaire âgée (B) est réduite en taille et présente une capillarisation plus faible et moins de SC, principalement dans les fibres de type II. Le schéma agrandi indique que les SCs du muscle sont situés à une plus grande distance des ECs et du capillaire les plus proches. Il est supposé que cette distance accrue réduit l'interaction cellule à cellule entre ces populations cellulaires et représente un mécanisme important qui sous-tend le nombre réduit de SCs activées après un stimulus chez les personnes âgées par rapport aux jeunes. Les populations de cellules résidant dans le muscle, notamment les fibroblastes, les macrophages et les péricytes, présentent des interactions similaires avec les SCs du muscle. L'évaluation précise de la capillarisation musculaire (C) est importante pour évaluer la perfusion musculaire, l'échange d'oxygène et la relation spatiale avec la SC musculaire.
Les SCs musculaires sont sans équivoque nécessaire à la régénération des tissus des muscles squelettiques, comme le montrent les données provenant de modèles animaux. Les muscles squelettiques qui ont été expérimentalement dépourvus de la population résidente de SC ne se régénèrent pas après une nécrose induite par une blessure. La nécrose des fibres, caractéristique qui distingue la régénération de la réparation musculaire, est suivie de la reconstitution des protéines cytostructurales des fibres et d'une éventuelle récupération complète du tissu musculaire. Bien que les SCs résidents du muscle soient le principal moteur du processus de régénération après la nécrose des fibres, il existe un certain nombre de cellules résidentes qui répondent aux lésions musculaires, y compris, mais sans s'y limiter, les progéniteurs mésenchymateux/ fibro-adipogènes, les péricytes et les ECs. Il a été démontré que ces cellules, et plus particulièrement les ECs, contribuent à la régénération et à la réparation du muscle, ainsi qu'à sa santé générale. Au cours des premières étapes du processus de régénération du muscle, on observe une angiogenèse et une revascularisation importantes au niveau du site de la lésion, avec des ramifications et des anastomoses étendues, sous l'effet de l'activation et de la prolifération concomitantes des populations des ECs. Lorsque la revascularisation est émoussée, la régénération du muscle reste incomplète, et inversement, lorsque la vascularisation est accrue, la régénération semble améliorée, ce qui suggère que les populations de EC et de SC sont toutes deux essentielles à la régénération.
De plus en plus de preuves soutiennent l'idée que la micro-vascularisation est vitale pour la régulation de la fonction des cellules satellites, et pas seulement par l'apport d'oxygène et de nutriments, mais aussi par l'apport de facteurs de signalisation. Christov et al. ont identifié une forte corrélation entre le nombre de SC et de capillaires associés à une myofibre. In vitro, des expériences ont démontré que les ECs augmentent la prolifération et la croissance des cellules myogéniques (d’origine musculaire), alors que ces cellules sont concomitamment proangiogéniques (qui favorisent la fabrication des vaisseaux sanguins). En effet, au fur et à mesure que les cellules myogéniques se différencient (c'est-à-dire qu'elles passent des myocytes aux myotubes), elles stimulent l'élongation et la luménisation des capillaires. Ces actions cellulaires sont dirigées par une pléthore de facteurs de croissance paracrines, notamment le facteur de croissance endothélial vasculaire (VEGF), et d’autres dont le facteur de croissance basique des fibroblastes. Le VEGF, principal régulateur de l'angiogenèse et de la revascularisation dans le muscle adulte, a fait l'objet d'une attention particulière en relation avec la régénération musculaire, car il est sécrété par les cellules myogéniques pendant la différenciation, favorise la migration des cellules myogéniques et protège contre l'apoptose des cellules myogéniques. Des preuves suggèrent que les ECs des capillaires matures, in vivo, ne produisent pas de VEGF mais expriment ses récepteurs R1 et R2, qui sont également présents sur les cellules myogéniques. Tous ces éléments indiquent que le VEGF est un facteur co-régulateur à la fois pour le processus de remodelage vasculaire et pour la regénération simultanée. Conformément à cette hypothèse, il a été démontré que l'administration d'ADN complémentaire du VEGF par le biais d'un virus adéno-associé ou d'une matrice collatérale enduite de VEGF à un muscle blessé améliore la prolifération et la régénération des SCs musculaires in vivo. En revanche, la délétion conditionnelle du VEGF entraîne une perte capillaire et une apoptose, avec un grand nombre de cellules apoptotiques identifiées comme étant des ECs et des SCs musculaires.
Plus récemment, Verma et al. (2018) ont démontré la relation intime entre les EC et les SCs via une voie de signalisation médiée par le VEGF. Ils ont révélé que ~40% des SCs musculaires étaient en contact direct avec les ECs des capillaires dans le muscle tibialis anterior. Ils ont également confirmé que le VEGFA est fortement exprimé dans les SCs musculaires quiescents et actifs. Un modèle de délétion du VEGFA spécifique au SC musculaire a entraîné une plus grande distance entre le SC et les ECs des capillaires in vivo, et une capacité réduite à faciliter la migration des ECs in vitro. À l'inverse, les SCs musculaires isolés d'animaux exprimant deux fois plus de VEGF que leurs homologues de type sauvage ont révélé une distance anatomique significativement plus courte entre les SCs et les ECs. En outre, les SCs musculaires ont montré une plus grande expression de VEGF après une blessure aiguë par cardiotoxine. L'ensemble de ces résultats confirme l'existence d'une relation fonctionnelle entre les SCs musculaires et les EC, facilitée par la signalisation du VEGF. Dans l'ensemble, la capillarisation musculaire semble non seulement faciliter l'interaction directe EC-SC, mais aussi permettre la distribution de gradients de facteurs de croissance provenant d'autres types de cellules.
À un âge avancé, la capacité de régénération du muscle est très réduite. La question de savoir si le dysfonctionnement des SCs avec le vieillissement est intrinsèque ou lié à l'environnement extrinsèque comme l'apport de facteurs de signalisation circulants clés, fait encore l'objet d'un débat considérable. Indépendamment du mécanisme, il semble y avoir une déficience liée à l'âge dans le processus de régénération des muscles des rongeurs après une blessure. Des travaux antérieurs examinant la réponse précoce à une lésion musculaire suggèrent que les rongeurs âgés ne sont pas capables de rétablir la surface de section transversale du muscle (CSA) 30 jours après la lésion. Il a été observé que les animaux âgés (24 mois) présentent une réponse régénérative altérée à l'injection de cardiotoxine. Cependant, ce problème a été résolu chez les animaux âgés qui se sont entraînés pendant 8 semaines avant la blessure. Par ailleurs, une plus grande capillarisation chez les animaux âgés entraînés a été observée par rapport à leurs homologues âgés et sédentaires, ce qui suggère que la revascularisation dans la réponse régénérative puisse faciliter une meilleure récupération. Dans l'ensemble, la capillarisation musculaire semble être un facteur de régénération avec le vieillissement.
L'observation d'une relation cellule satellite-capillaire in vitro ou en utilisant des modèles animaux a plus récemment été soutenue par un nombre limité d'études sur le muscle squelettique humain. Il a été montré une relation anatomique étroite entre les SCs et les capillaires, les SCs activées (c'est-à-dire non quiescentes ou en prolifération) étant situées plus près des capillaires que leurs homologues quiescentes. Dans les modèles expérimentaux humains, les biopsies musculaires sont généralement prélevées au repos et des heures/jours/semaines après un exercice/un dommage (par exemple, une contraction musculaire excentrique). Il a été montré que le pool de SC se développe de manière significative en réponse à un seul épisode de dommages musculaires induits par une contraction excentrique. Des changements significatifs dans la teneur en SC du muscle sont détectables dès ~24 h et atteignent leur maximum environ 72 h après le dommage. Dans les modèles de lésions musculaires induites par une contraction excentrique provoquée électriquement, la teneur en SC musculaire peut atteindre un pic et rester élevée jusqu'à 192 heures (8 jours) de récupération post-lésionnelle. Récemment, il a été observé que la perfusion des myofibres peut être essentielle à l'activation des SCs en réponse à un stimulus endommageant le muscle. Les jeunes hommes en bonne santé avec un degré plus élevé de capillarisation des fibres musculaires ont une plus grande activation et expansion du pool de SC musculaire en réponse à un épisode de dommages musculaires induits par une contraction excentrique volontaire. Dans l'ensemble, ces données humaines mettent en évidence l'étroite proximité anatomique et la relation corrélative entre les SCs musculaires et les EC pendant la réponse de réparation musculaire. La proximité spatiale et l'interaction entre les SCs musculaires et les EC pour le maintien du contenu en CS dans le muscle squelettique sont mises en évidence lorsque cette relation devient "dérégulée". À côté de divers états pathologiques, des recherches ont été menées sur la forte relation apparente entre le nombre et la fonction des SCs musculaires résidents et la capillarisation des fibres au cours de la sarcopénie liée à l'âge (voir le modèle hypothétique présenté dans la figure 2).
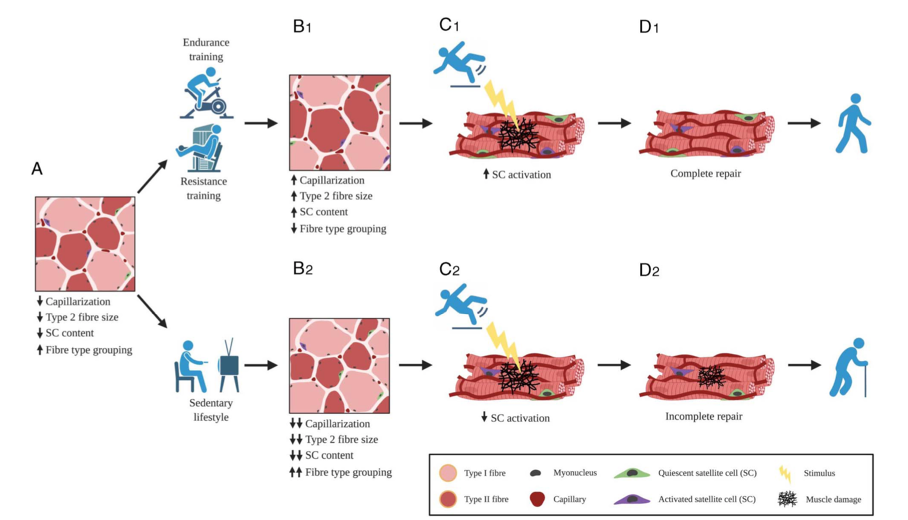
Figure 2. Modèle hypothétique du rôle de l'entraînement physique pour améliorer le muscle âgé. A. Représentation graphique d'un muscle squelettique humain âgé, présentant une perte de CSA de type II, une augmentation de l'incidence du regroupement des types de fibres (c'est-à-dire la perte du motif normal en " damier "), une diminution des indices de capillarisation et une réduction de la teneur en SC du muscle. B1. L'exercice volontaire ou l'activité physique, qui conduit à un réseau microvasculaire amélioré pouvant soutenir l'hypertrophie musculaire et augmenter l'activation et la fonction des SCs. Après un stimulus tel qu'une lésion ou une blessure musculaire (C1), les améliorations de la capillarisation induites par l'entraînement facilitent une meilleure "réactivité" des SCs musculaires (y compris une plus grande activation et une expansion du pool de SC), ce qui conduit finalement à une réparation musculaire plus complète et au retour à une fonction normale (D1). À l'inverse, un mode de vie sédentaire accompagné d'une activité physique réduite (B2) entraîne une perte exacerbée de la CSA musculaire, de la capillarisation et de la fonction SC avec le vieillissement. Après un stimulus traumatisant (C2), le muscle âgé sédentaire avec une capillarisation et une fonction SC réduites peut présenter un processus de réparation plus lent ou " incomplet " (D2), y compris une possible diminution de la qualité du muscle (c'est-à-dire une infiltration de graisse ou une fibrose), une restauration incomplète de la CSA et, finalement, l'empêchement d'un retour à une fonction et une force normales.
Au niveau de la fibre musculaire, le vieillissement est caractérisé par une perte préférentielle de la CSA des myofibres de type II, qui s'accompagne d'une réduction du nombre et de la fonction des SCs spécifique aux fibres de type II. Cette observation a conduit à l'hypothèse que la perte du nombre de SCs musculaires peut être un facteur important contribuant à la perte de masse musculaire avec l'âge. Dans une étude récente, un groupe de recherche a signalé que les SCs musculaires remplissent un rôle clé dans le maintien de la fonction physique et de l'hypertrophie des myofibres au cours de l'activité tout au long de la vie. Il est largement admis que tout au long de la vie, le muscle squelettique humain est soumis à des défis anaboliques et cataboliques répétés et que, collectivement, ces événements sont essentiels au développement final de la sarcopénie liée à l'âge. Étant donné qu'il est impossible de suivre un individu tout au long de sa vie, l'immobilisation d'un membre a été utilisée comme modèle d'atrophie musculaire à court terme (par exemple, 5 ou 14 jours) induite par la maladie. Les travaux utilisant ce modèle ont rapporté une réduction du potentiel régénérateur du muscle squelettique avec le vieillissement chez l'homme. En effet, après 14 jours d'immobilisation du genou sur une seule jambe suivis de 30 jours de recharge (c'est-à-dire d'un entraînement en résistance), les jeunes hommes ont pu récupérer la taille du muscle et une augmentation à court terme de la teneur en SC du muscle, alors que les hommes plus âgés ont montré une récupération incomplète avec un changement limité de la taille du pool de SC. Il a donc été émis l'hypothèse que
l'optimisation du nombre de SC était une stratégie importante pour résister à l'apparition et au développement de la sarcopénie liée à l'âge, qui est souvent exacerbée pendant les périodes d'inactivité (Fig. 2). Cela peut être particulièrement vrai pour les fibres de type II car elles semblent être préférentiellement ciblées par le processus sarcopénique.
Au-delà de la perte observée du contenu musculaire en SC, leur fonction semble également décliner avec le vieillissement. Chez l'homme, la fonction du SC musculaire est généralement évaluée dans des biopsies musculaires prélevées au repos et à des points de temps ultérieurs après un seul exercice. La différence de taille du pool de SC et d'activation entre le repos et chaque point de temps après l'exercice est utilisée comme une mesure approximative de la fonction de SC in vivo. Il a été démontré que l'expansion du pool de SC des myofibres de type II était retardée, avec une réponse d'activation émoussée, dans les premières ~72 h après un seul exercice de résistance chez les adultes plus âgés. La réalisation de contractions excentriques ou d'un exercice de résistance permet d'évaluer la réparation des myofibres ou une réponse de croissance, respectivement, mais ne constitue pas un véritable reflet de la régénération. Karlsen et al. ont été les premiers à évaluer la réponse SC musculaire chez les jeunes et les adultes plus âgés pendant la régénération des myofibres. Dans cette étude, des biopsies ont été prélevées au repos et 9 jours après une seule séance de contractions excentriques forcées stimulées électriquement, ce qui a entraîné l'apparition de nécrose et de fibres en régénération. Cette étude a rapporté qu'il n'y avait pas de différences significatives dans la modification du contenu en SC musculaire entre les individus jeunes et âgés pendant la régénération musculaire. En prenant les trois modèles (c'est-à-dire les contractions excentriques, l'exercice de résistance et la stimulation électrique), ces données suggèrent que pendant le vieillissement humain, les SCs musculaires restent fonctionnels, mais leur réponse ou leur réactivité peut être diminuée. Il a été suggéré que l'altération de la fonction des SC contribuait au développement de la sarcopénie ou à la réduction de la réponse adaptative des muscles à l'entraînement ou à la récupération des blessures observée avec le vieillissement. De plus en plus de preuves suggèrent que cela pourrait être le résultat d'une réduction de la capillarisation des myofibres et, par conséquent, d'une mauvaise régulation de la distribution des facteurs circulants essentiels à la fonction des SCs. Parallèlement à la perte de SC musculaire et de CSA des fibres, il semble également y avoir une perte significative de microvascularisation avec le vieillissement. Il a été observé qu'il y a une perte sélective de capillaires associés aux fibres de type II chez les hommes âgés par rapport à leurs homologues plus jeunes. Outre la morphologie de la microvascularisation, la fonction vasculaire semble également altérée chez les adultes âgés. Le flux sanguin artériel est réduit chez les adultes âgés par rapport aux jeunes adultes. Cette altération du débit sanguin artériel liée à l'âge est probablement liée à plusieurs facteurs, notamment une vasoconstriction chronique, une demande en oxygène plus faible et une diminution de la fonction de la paroi endothéliale chez les adultes âgés. Les adultes âgés présentent donc une réponse réduite du débit sanguin artériel à l'exercice et à la nutrition par rapport aux adultes plus jeunes, ce qui peut également être lié à une moindre capillarisation des myofibres. Ceci est en accord avec les preuves rapportant une relation entre une faible capillarisation musculaire, une sensibilité réduite à l'insuline, une livraison réduite d'acides aminés, et une "résistance anabolique" avec le vieillissement. Dans l'ensemble, l'altération liée à l'âge de la morphologie microvasculaire, mais aussi du flux sanguin artériel et microvasculaire vers les fibres musculaires, limite probablement l'apport de facteurs systémiques, ce qui, selon l'hypothèse, contribuerait à l'altération de la fonction SC chez les adultes âgés.
Il a été signalé des augmentations de la capillarisation des fibres musculaires après un entraînement en résistance chez les jeunes adultes. Cependant, il y a moins d'accord dans la littérature concernant la réponse angiogénique après un entraînement à l'exercice de résistance chez les adultes plus âgés alors que d’autres études ne montrent pas d'augmentation de la capillarisation des fibres musculaires après un entraînement prolongé à la résistance chez les adultes plus âgés. Cette divergence peut être attribuée aux différentes intensités d'exercice (par exemple, un pourcentage différent du maximum d'une répétition) ou au volume d'exercice (par exemple, le total des séries et des répétitions du travail effectué) utilisés dans les diverses études. Compte tenu de l'importance de la capillarisation dans le cadre de l'adaptation à l'exercice et de la fonction SC, la détermination précise de la capillarisation dans le muscle squelettique est essentielle. L'indice du périmètre d'échange capillaire des fibres (capillary-to-fiber perimeter exchange index - CFPE) a été examiné en détail, car il reflète la capacité de perfusion des fibres musculaires en prenant en compte le périmètre des fibres et peut donc représenter une évaluation plus précise de la capillarisation des myofibres et de la circulation sanguine. Il est important de noter que le CFPE peut être un facteur limitant la croissance des myofibres pendant un entraînement prolongé à l'exercice de résistance chez les adultes âgés. Ceci est soutenu par l'observation que les adultes plus âgés avec une faible CFPE au départ n'ont pas montré d'augmentation de la CSA musculaire après un entraînement en résistance, alors que les adultes plus âgés avec une CFPE élevée au départ ont été capables d'augmenter la CSA des myofibres de type II. Ces améliorations ont été reflétées par la réponse du pool de CS musculaire, seuls ceux dont le CFPE était le plus élevé ont démontré une expansion du pool de CS. De plus, les auteurs ont montré qu'un entraînement prolongé peut améliorer la réponse aiguë des CS à un seul exercice de résistance chez les hommes jeunes et âgés, respectivement. Chez les adultes plus âgés, l'amélioration de la réponse aiguë du SC était principalement associée à une augmentation de la capillarisation des fibres musculaires induite par l'exercice et à une réduction de la distance entre le SC et le capillaire le plus proche. Dans l'ensemble, ces observations confirment l'hypothèse selon laquelle le réseau capillaire des fibres musculaires peut être un facteur limitant la fonction des CS et l'hypertrophie ultérieure des fibres musculaires dans le tissu musculaire squelettique humain. Cependant, il ne peut être exclu que des facteurs (par exemple, des changements dans les protéines de signalisation, des adaptations neuromusculaires) qui changent avec le vieillissement ou après un entraînement physique puissent être d'une importance égale pour la fonction SC musculaire altérée chez les adultes plus âgés.





