Le tableau clinique de l'instabilité postérieure est généralement peu évident, ce qui rend son diagnostic difficile et le fait souvent passer inaperçu. Les patients ne rapportent généralement pas une sensation claire d'instabilité mais juste une vague douleur, une faiblesse, et/ou un claquement articulaire, avec parfois une histoire d'un événement traumatique aigu associé à l'apparition des symptômes. Les microtraumatismes répétés du complexe capsulolabral postéro-inférieur peuvent entraîner une instabilité postérieure, en particulier chez les soldats, les grimpeurs, les haltérophiles, les nageurs et ceux qui pratiquent qui pratiquent des activités overhead. Un évènement traumatique initial n’est donc que rarement le point de départ initial de l’instabilité postérieure d’épaule, alors que c’est normalement le cas pour les instabilités antérieures d’épaule (Albano 2020).
Il arrive bien entendu que le diagnostic clinique soit plus évident dans le temps, notamment lorsque le patient souffre d’instabilité multidirectionnelle d’épaule, mais tout l’enjeu repose dans le fait de diagnostiquer précocement les instabilités postérieures d’épaule pour pouvoir proposer le plan de traitement adéquat en fonction des structures atteintes. Pour cela, l’IRM (arthro-IRM) reste un examen de référence, et il s’agit de bien connaître toutes les structures pouvant être impliquées dans les instabilités de la partie postérieure de l’épaule, elles sont listées ci-après :- Glène. Les éléments à rechercher sont une surface articulaire plate, une hypoplasie, une rétroversion de la surface articulaire, une lésion de « Bankart inversé » avec atteinte osseuse où l’on retrouve un dommage osseux au niveau de la partie postérieure de la glène, ou une déficience osseuse du rebord glénoïdien postéro-inférieur (appelée « lazy J » ou « delta ») (Mulligan 2005).
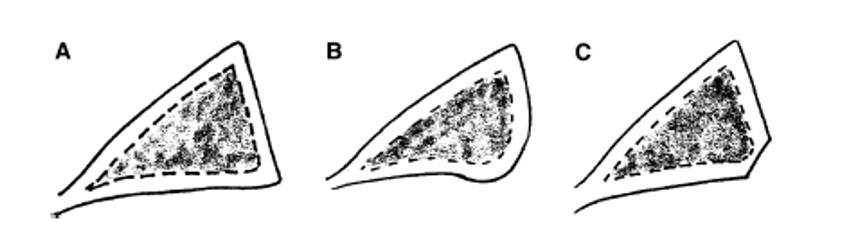
Représentation schématique des formes des bords postéro-inférieurs du rebord glénoïdien (adapté de Weishaupt (2000):
A, de type normal
B de type "lazy J" correspondant généralement a des déficiences atraumatiques
C de type « delta » correspondant généralement a des déficiences traumatiques.
- Tête Humérale. Les éléments à rechercher sont une surface articulaire plate, une hypoplasie, une varisation du col huméral, une translation postérieure de la tête humérale, une lésion inversée de Hill-Sachs (Reverse Hill Sachs = Mc Laughlin lesion). Cette lésion de Mc Laughlin est définie comme une fracture par impaction de la face antéro-interne de la tête humérale suite à une luxation postérieure de l'humérus (Alepuz 2016).
- Labrum Postérieur. Les éléments à rechercher sont un labrum aplati, une lésion de « Bankart inversé » avec atteinte des tissus mous, une lésion de KIM qui correspond à des déchirures à la jonction entre le cartilage glénoïdien postéro-inférieur et le labrum, mais sans décollement labral complet (détachement partiel de la partie profonde du labrum) (Shah 2020), ou alors une avulsion du manchon périostique labrocapsulaire postérieur (POLPSA posterior labrocapsular periosteal sleeve avulsion) (YU 2002) qui est une lésion aigue où le labrum, bien que décollé, est intact dans son intégrité et rattaché au périoste. Ce dernier type de lésion nécessite une réparation chirurgicale.
- Capsule et ligaments. Les éléments à rechercher sont une atteinte du ligament gléno-huméral inférieur faisceau posterieur (Doehrmann 2021), une lésion de la partie postérieure de la capsule, une lésion de Bennett qui correspond à l’ossification du faisceau postérieur du ligament gléno-huméral inférieur. On retrouve aussi cette lésion de Bennett sous le nom « d’exostose du lanceur », très présente dans les sports de lancer tels le baseball, en lien sans doute avec l’importante phase de décélération nécessaire au lancer, cette lésion est extra articulaire et peut être traitée chirurgicalement, ou non (Karcich 2019).
- Un cas particulier: l’atteinte congénitale. L'instabilité postérieure peut également être associée à des anomalies congénitales telles que la redondance ou la déformation capsulolabrale postérieure et la rétroversion glénoïdienne (augmentation de l'angulation postérieure de la fosse glénoïde). Il en résulte une tête humérale centrée en arrière (HH) qui peut prédisposer à une instabilité postérieure, et généralement, si elle est présente, elle se produit de manière bilatérale (Tannenbaum 2011).
En clinique, il existe plusieurs tests de référence (test d’instabilité postérieur, Jerk test, posterior drawer test, Kim test, …), mais étant donné le nombre de structures potentiellement impliquées dans la pathologie, et le peu de spécificité de ces tests, la recommandation est de faire un cluster de test, c’est-à-dire d’utiliser plusieurs de ces tests pour affiner la spécificité du diagnostic (Dhir 2018). Il est recommandé de combiner à minima le test d’instabilité postérieur avec le jerk test, et de s'appuyer sur une anamnèse approfondie, y compris concernant le mécanisme de la blessure et/ou le sport pratiqué ainsi que de rechercher et d’évaluer les facteurs de risque spécifiques du sportif, et bien entendu de compléter dans la foulée par un arthro-IRM pour objectiver les structures atteintes en cas d’examen clinique positif.

Cluster de 2 tests pour l’évaluation clinique des instabilités postérieures d’épaule. (Kinesport 2021).
Dans une revue rétrospective sur 5 ans de 115 patients atteints de PSI (diagnostic confirmé par l’anamnèse et l’imagerie) isolé (pas d’instabilité antérieure, pas d’instabilité multidirectionnelle, pas de SLAP), Julia Lee (2021) a mesuré les niveaux de douleur, d’instabilité récurrente, et d’évolution vers l'arthrose gléno-humérale dans le suivi à long terme. Sur 37 patients traités de manière conservatrice, 3 ont développé une arthrite gléno-humérale symptomatique, 17 ont vu leur douleur diminuer, tandis que 7 ont au contraire vu leur douleur augmenter. La douleur au cours du suivi était plus fréquente chez les patients non opérés que chez les patients opérés (P = 0,017). Il semblerait donc que,
bien que le traitement conservateur soit une option viable, une grande proportion de patients risque de conserver des douleurs à l’épaule à moyen et long terme. De plus, chez les patients qui avaient eu un évènement traumatique initial,
15% ont évolué vers une instabilité chronique ainsi que vers une arthrose précoce, contre 0% chez les patients sans évènement traumatique initial.
Une équipe française, menée par A. Godenèche de SANTY à Lyon, a aussi en 2020 publié une étude rétrospective, incluant 117 patients opérés pour PSI entre 2000 et 2015. Les critères d'inclusion étaient une PSI symptomatique (subluxation et/ou douleur) avec des signes radiographiques d'érosion ou de fracture de la glène postérieure, des lésions postérieures du labrum ou des lésions de Hill Sachs inversées. Sur les 117 patients inclus, 84% des patients inclus présentaient des symptômes de subluxation et/ou de luxation, et 16% étaient douloureux sans symptômes cliniques de subluxation et/ou de luxation. Bien que ces différences ne soient pas statistiquement significatives, les auteurs ont trouvé que les patients souffrant de PSI traumatique ont connu davantage de récidives d'instabilité (15,6 % contre 4,8 %, p = 0,298) et une douleur plus faible sur l'EVA (1,5 ± 2,3 contre 2,6 ± 3,0, n.s.) par rapport à ceux atteints de PSI atraumatique. Les patients atteints de PSI atraumatiques étaient plutôt atteints sur leur côté dominant.
- La chirurgie peut donc être recommandée pour certains patients, notamment en cas d’atteinte traumatique, afin d'assurer une stabilité à long terme et un soulagement de la douleur, et ainsi permettre le retour au travail ou au sport. Les déchirures labrales et des tissus mous sont généralement traitées par la procédure de Bankart, tandis que les pertes osseuses ou les fractures associées de la glène sont fréquemment traitées par des procédures de blocage osseux.
Réparation arthroscopique des tissus mous
Leivadiotou (2015) a effectué une revue de littérature concernant cette technique opératoire. Il y a plusieurs variantes chirurgicales décrites dans la littérature, qualifiée parfois de Bankart postérieur :
- Réparation par point d’ancrage, avec ou sans plicature capsulaire antérieure, avec ou sans déplacement capsulaire postérieur
Les patients sont en général immobilisés dans une écharpe pendant 3 à 6 semaines (moyenne 3,5 semaines), en rotation externe dans la plupart des cas de réparation unique des tissus mous retrouvés dans la littérature.
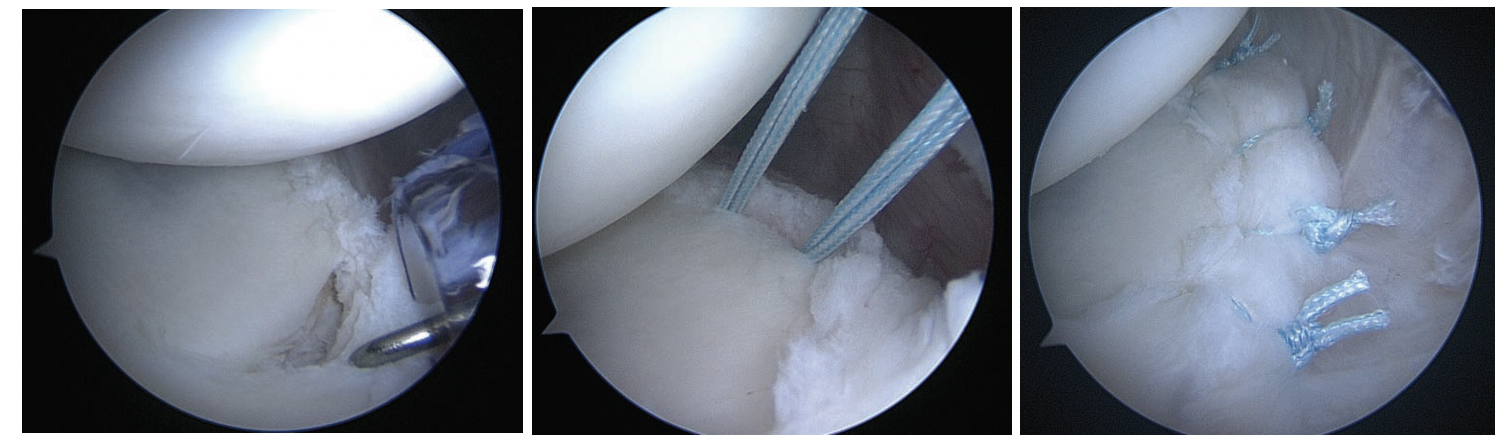
Lorsque le labrum postérieur était partiellement ou totalement détaché, des points d’ancrage suturés étaient utilisées pour effectuer la réparation. Bradley 2013.
Image 1 : Une sonde est placée dans le détachement labral postérieur vu depuis le portail antérieur.
Image 2 : Une vue démontrant le placement des ancres de suture au niveau du bord articulaire de la glène.
Image 3 : Vue finale de la plicature capsulolabrale postérieure avec ancres. La capsule a été avancée vers le haut, rétablissant la tension capsulaire postérieure et l'effet de contrefort du complexe capsule/labrum postérieur.
Stabilisation par bloc(s) osseux postérieur(s)
- Le bloc osseux postérieur par voie d’abord ouverte : La technique de bloc osseux postérieur par voie ouverte est la technique de référence pour traiter la PSI, mais pour certains cas plus complexes, comme par exemple en cas d’instabilité bi-directionnelle, il existe même une possibilité de double bloc osseux (antérieur + postérieur, tel décrit pour la première fois par Haeni, en 2018). Cependant, ces techniques présentent l’inconvénient de nécessiter une approche extensive, avec une large voie d’abord, un résultat cosmétique médiocre et la possibilité d'une insuffisance partielle postopératoire du muscle deltoïde. En outre, le placement correct de la greffe osseuse et le traitement des pathologies concomitantes telles que les lésions inverses de Hill- Sachs inversées, ainsi que les lésions du labrum postérieur, s'avèrent très difficiles, voire impossibles, par cette simple approche par voie ouverte. C’est pourquoi, depuis quelques années, sont aussi développées des techniques de stabilisation mini invasive, que nous allons détailler maintenant.
- Réparation par arthroscopie minimale invasive : (Smith 2012, Boileau 2013, Schwartz 2013, Wellman 2017). Une technique de stabilisation postérieure entièrement arthroscopique, avec greffe osseuse (d’os iliaque) postérieure en combinaison avec une reconstruction capsulaire postérieure peut être réalisée. Elle présente l’avantage d’être mini invasive, tout en offrant une réparation osseuse mais aussi des tissus mous. Les étapes clés de l'opération sont le placement précis et la fixation par vis de la butée osseuse au niveau de la glène postérieure sous contrôle arthroscopique, puis la refixation et la plicature capsulaire postérieure à l'aide de 2 ancres de suture pour créer une position extra-articulaire de la greffe.
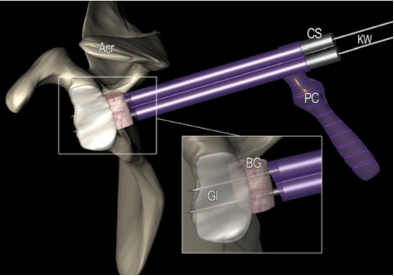
Schéma tridimensionnel d'une omoplate gauche. Le greffon osseux (BG) est fixé à la glène postérieure (Gl) à l'aide de deux broches en K parallèles (KW). (Smith 2012)
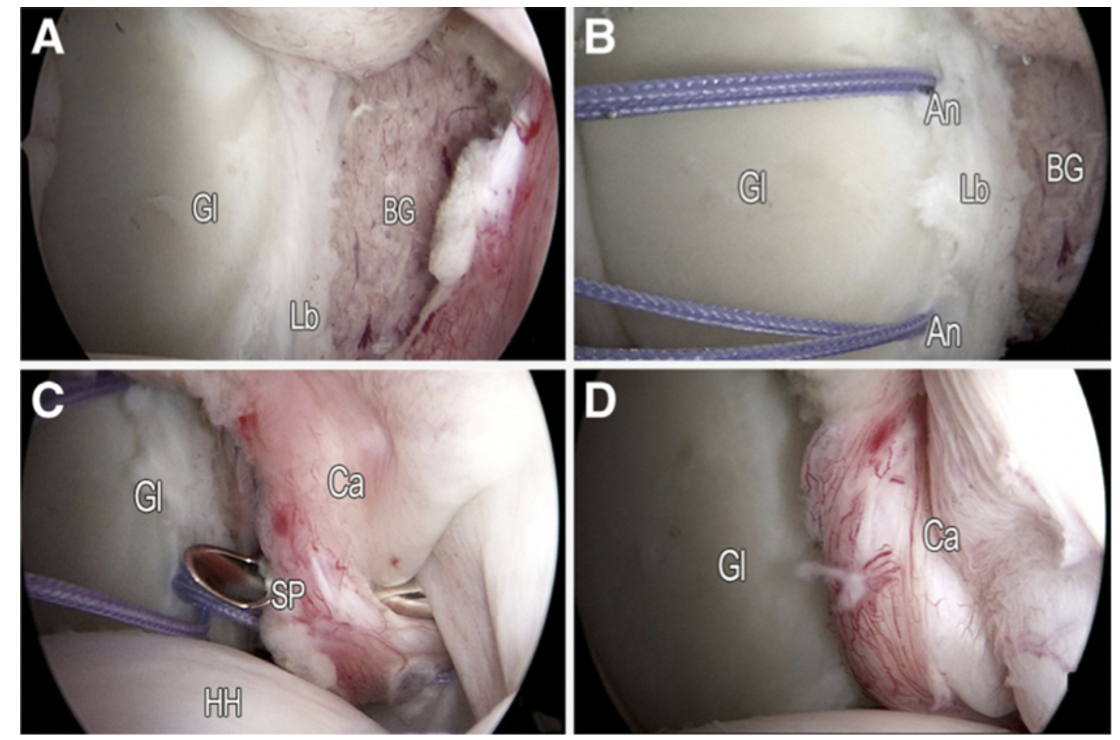
Épaule gauche (Smith 2012)
(A) Greffe osseuse (BG) placée au niveau du rebord glénoïdien postérieur (Gl). (Lb, labrum). (B) Deux ancres de suture (An) positionnées au-dessus et au-dessous du greffon osseux.
(C) Application de la suture en boucle à travers la capsule (Ca) avec un passeur de suture incurvé (SP). (HH, tête humérale).
(D) Résultat final de la plicature capsulaire postérieure après le nouage.
Chirurgie
En cas de chirurgie, les techniques opératoires et les protocoles varient beaucoup entre les chirurgiens, et il est difficile de dégager un consensus de prise en charge post-opératoire. Globalement, après 4 semaines d’immobilisation passive en abduction, il s’agit de récupérer progressivement les amplitudes passives, puis actives, pour obtenir un ROM complet à environ 2-3 mois post-opératoire. Puis il s’agit d’obtenir >80% de LSI sur les tests de force en comparant au côté contro-latéral, et enfin passé ce stade, de débuter un programme de réhabilitation sport-spécifique pendant au moins 6 semaines supplémentaires. Il semblerait que les meilleurs résultats soient observés avec une gestion postopératoire prudente, avec un délai de retour au sport d'environ 4-6 mois. (Backer 2018)
Traitement Conservateur
Bien que la chirurgie soit le traitement de référence pour de bon nombre de patients, il s’avère aussi parfois que le traitement conservateur soit tenté dans un premier temps. Ce sera typiquement le cas pour un patient atraumatique, sans atteinte majeure des tissus mous à l’arrière de l’épaule.
Le traitement conservateur peut être recommandé comme traitement initial, notamment en absence d’atteinte traumatique, bien qu’il existe actuellement peu de recherches sur la gestion conservatrice de l'instabilité postérieure (Lyn Watson, 2017). Dans ce même article, Lyn Watson, clinicienne australienne de référence sur l’épaule, présente un programme de rééducation complet pour la gestion conservatrice de l'instabilité postérieure en mettant l'accent sur le contrôle de la scapula et de la tête humérale. Pour commencer, il est possible d’effectuer la SSMP (Shoulder Symptoms Modification Procedure, Jeremy Lewis, 2016). En effet, une partie essentielle de l'examen clinique consiste à évaluer l'effet de la correction de la position ou du mouvement de la scapula et de la tête humérale. Les manœuvres de correction de la scapula et de la tête humérale ont été décrites dans l'évaluation de nombreuses pathologies de l'épaule, allant de l'instabilité antérieure et du conflit au syndrome du défilé thoracique. Corriger la position et le mouvement de la scapula et/ou de la tête humérale lors de la réalisation de tests spéciaux, de mouvements passifs et actifs, et de tests de résistance permet de déterminer quels patients peuvent être susceptibles d'être corrigés et de bénéficier d'un traitement conservateur. L'amélioration de l'amplitude des mouvements, la réduction ou l'élimination des symptômes, ou l'amélioration de la force suite à l'application des corrections peuvent contribuer au tableau diagnostique et souligner qu'un patient est susceptible de répondre à des stratégies de réadaptation qui corrigent la position scapulaire et la tête humérale.
Le plus souvent, les patients atteints de PSI répondent positivement à une composante de rotation latérale +/- une légère élévation de l’omoplate qui a tendance à se trouver en position basse +/- un léger tilt postérieur. Parfois, un décollement (winging) de la scapula peut être retrouvé chez les patients atteints de PSI. Cela pourrait-être une réponse adaptative lorsque les patients décollent la scapula pour essayer de placer la fosse glénoïde derrière la tête humérale afin d’augmenter la surface de contact et d'empêcher la subluxation.
- Faudrait-il corriger la scapula en inclinaison postérieure et/ou en rétraction dans ce cas ? Il semblerait que cette correction emmène chez ce type de patient à aggraver l'instabilité et les symptômes car la fosse glénoïde sera orientée plus en arrière, ce qui majorera l’instabilité (Watson 2017).
Quelques études sur le traitement conservateur des PSI soulignent la valeur du renforcement progressif du deltoïde et de la coiffe des rotateurs, sur une durée suffisamment longue pour avoir un effet, c’est-à-dire minimum 8-12 semaines (McIntyre 2016).
Lyn Watson, propose un programme de réhabilitation complet avec critères de passages non temporels, pour PSI, sur une durée globale de 3 à 6 mois. Il se compose en une phase de travail de la scapula suivi de 5 phases de travail progressives :
- phase 1 : plan frontal, 0 degrés d’abduction
- phase 2 : plan frontal + sagittal, 0-45 degrés d’abduction
- phase 3 : plan frontal + sagittal, 45-90 degrés d’abduction
- phase 4 : tous les plans, >90 degrés d’abduction
- phase 5 : spécifique au sport pratiqué
La charge de travail nécessaire dans chaque phase et le dosage de départ pour chaque exercice dépendent toujours de l'évaluation individuelle de la capacité du patient à effectuer le mouvement correctement, avec un bon contrôle de la scapula et de la tête humérale, et sans douleur. En général, les patients évoluent sur plusieurs semaines en commençant par une phase d’activation/recrutement musculaire (1-3 séries de 20 répétitions effectuées 2 ou 3 fois par jour), suivi d'une phase d'endurance musculaire (1-3 séries de 10-15 répétitions, 25-30% 1 RM), pour passer ensuite à une phase de force (3-4 séries de 6-8 répétitions, 60-80% 1 RM), puis de développement des qualités physiques spécifiques au sport pratiqué.








