Le système nerveux est plastique
Il n’est pas rare que les physiothérapeutes, les entraîneurs sportifs, les entraîneurs de « performance humaine » et les médecins orthopédistes trouvent surprenant qu’une blessure musculo-squelettique puisse induire des changements dans la fonction et la structure du système nerveux central. Cela est dû, en partie, au fait de considérer les affections orthopédiques comme de simples pathologies de la structure et de la fonction biomécanique. La conceptualisation d'une lésion musculaire ou d'une entorse ligamentaire comme une perturbation ou une instabilité du système musculosquelettique périphérique uniquement, sans effet en cascade sur l'ensemble du corps. L'étonnement initial est également secondaire à l'enseignement historique dans de nombreuses disciplines thérapeutiques et de réadaptation selon lequel le système nerveux adulte est assez stable, sans grand potentiel de changement. Cela était évident lorsque les thérapies initiales pour de nombreuses pathologies entraînant des déficiences fonctionnelles importantes (accident vasculaire cérébral, lésion cérébrale, sclérose en plaques, fractures, etc.) étaient axées sur la « compensation » ou l'adoption de nouvelles stratégies pour soutenir les activités de la vie quotidienne, qui ne rétablissaient pas la fonction du membre concerné. Ces stratégies reposaient principalement sur une dépendance excessive à l'égard du membre sain controlatérale et ce que l'on appelle la "non-utilisation apprise" qui a été encouragée à une époque ! Après des décennies de travail clinique et scientifique, nous savons maintenant avec certitude que le système nerveux adulte est hautement plastique et que les anciennes hypothèses selon lesquelles la récupération de la fonction du système nerveux n'était pas possible ont été laissées à la poubelle de l'histoire de la médecine.
Le Dr Edward Taub a été l'un des premiers scientifiques à montrer qu'un entraînement direct et ciblé du membre concerné (initialement chez des patients hémiplégiques) pouvait effectivement entraîner une récupération et une neuroplasticité associée. Les premières thérapies, qui se poursuivent encore aujourd'hui, sont appelées « thérapie par mouvements induits par la contrainte », qui consiste à contraindre le côté sain pour utiliser le côté blessé. Cette utilisation dédiée des membres favorise la stimulation neuronale qui, avec le temps, permet la récupération fonctionnelle. Cela ne fait que quelques décennies que les livres ont reconnues la capacité fondamentale du système nerveux adulte à subir des changements, et depuis lors, le rythme et l'ampleur de ces changements n'ont fait que s'accélérer avec notre capacité à les mesurer ! Tout récemment, il a été démontré qu'une seule séance d'entraînement à l'équilibre pendant 30 minutes modifiait la structure fondamentale du cortex moteur pour s'adapter à la capacité accrue de contrôle postural ! Nous vivons vraiment une époque scientifique passionnante.
Le Dr Edward Taub a été l'un des premiers scientifiques à montrer qu'un entraînement direct et ciblé du membre concerné (initialement chez des patients hémiplégiques) pouvait effectivement entraîner une récupération et une neuroplasticité associée. Les premières thérapies, qui se poursuivent encore aujourd'hui, sont appelées « thérapie par mouvements induits par la contrainte », qui consiste à contraindre le côté sain pour utiliser le côté blessé. Cette utilisation dédiée des membres favorise la stimulation neuronale qui, avec le temps, permet la récupération fonctionnelle. Cela ne fait que quelques décennies que les livres ont reconnues la capacité fondamentale du système nerveux adulte à subir des changements, et depuis lors, le rythme et l'ampleur de ces changements n'ont fait que s'accélérer avec notre capacité à les mesurer ! Tout récemment, il a été démontré qu'une seule séance d'entraînement à l'équilibre pendant 30 minutes modifiait la structure fondamentale du cortex moteur pour s'adapter à la capacité accrue de contrôle postural ! Nous vivons vraiment une époque scientifique passionnante.
Mécanismes de la neuroplasticité induite par les blessures musculosquelettiques
Neuroplasticité résultante après une lésion du ligament croisé antérieur
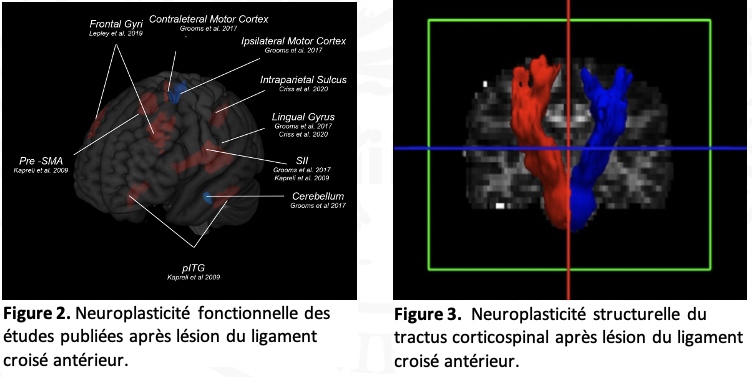
Un espoir d’innovation thérapeutique !
Prochains posts
Prochains posts
Prochains posts
Prochains posts
Prochains posts
Prochains posts
Prochains posts
La prochaine série de posts explorera les compensations des blessures qui se produisent dans le système nerveux et entrera dans le détail des changements fonctionnels du cerveau avec un synopsis de nos recherches les plus récentes. Nous commencerons également à inclure des méthodes de physiothérapie pour atténuer la compensation neuroplastique et permettre une approche réparatrice non seulement du système musculosquelettique mais aussi du système nerveux !
Bibliographie
- Taubert M, Mehnert J, Pleger B, Villringer A. Rapid and specific gray matter changes in M1 induced by balance training. NeuroImage. doi:10.1016/j.neuroimage.2016.03.017
- Kapreli E, Athanasopoulos S, Gliatis J, et al. Anterior Cruciate Ligament Deficiency Causes Brain Plasticity: A Functional MRI Study. Am J Sports Med. 2009;37(12):2419-2426. doi:10.1177/0363546509343201
- Grooms DR, Page SJ, Onate JA. Brain Activation for Knee Movement Measured Days Before Second Anterior Cruciate Ligament Injury: Neuroimaging in Musculoskeletal Medicine. J Athl Train. 2015;50(10):1005-1010. doi:10.4085/1062-6050-50.10.02
- Criss CR, Onate JA, Grooms DR. Neural activity for hip-knee control in those with anterior cruciate ligament reconstruction: A task-based functional connectivity analysis. Neuroscience Letters. 2020;730:134985. doi:10.1016/j.neulet.2020.134985
- Grooms DR, Page SJ, Nichols-Larsen DS, Chaudhari AMW, White SE, Onate JA. Neuroplasticity Associated With Anterior Cruciate Ligament Reconstruction. J Orthop Sports Phys Ther. 2017;47(3):180-189. doi:10.2519/jospt.2017.7003
- Lepley AS, Grooms DR, Burland JP, Davi SM, Kinsella-Shaw JM, Lepley LK. Quadriceps muscle function following anterior cruciate ligament reconstruction: systemic differences in neural and morphological characteristics. Exp Brain Res. 2019;237(5):1267-1278. doi:10.1007/s00221-019-05499-x
- Lepley AS, Ly MT, Grooms DR, Kinsella-Shaw JM, Lepley LK. Corticospinal tract structure and excitability in patients with anterior cruciate ligament reconstruction: A DTI and TMS study. NeuroImage: Clinical. 2020;25:102157. doi:10.1016/j.nicl.2019.102157



